Журнал «Здоровье ребенка» Том 17, №7, 2022
Вернуться к номеру
Діагностична цінність маркерів запалення та інсулінорезистентності при неалкогольній жировій хворобі печінки у дітей
Авторы: Степанов Ю.М., Завгородня Н.Ю., Татарчук О.М., Кленіна І.А., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
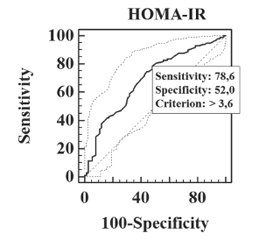
Актуальність. Індекси інсулінорезистентності, зокрема HOMA-IR, та циркулюючі цитокіни є перспективними маркерами неінвазивної оцінки ступеня пошкодження гепатоцитів та метаболічного ризику при неалкогольній жировій хворобі печінки (НАЖХП) у дітей і можуть бути використані для відбору педіатричних хворих з ризиком несприятливого перебігу захворювання. Мета роботи: визначити діагностичну цінність маркерів інсулінорезистентності та циркулюючих цитокінів при неалкогольній жировій хворобі печінки у дітей. Матеріали та методи. У дослідження включено 170 пацієнтів 6–17 років (середній вік 12,15 ± 2,51 року). Наявність стеатозу печінки визначалась шляхом транзієнтної еластографії. За наявністю стеатозу, неалкогольного стеатогепатиту (НАСГ) та ожиріння пацієнти розподілені на 4 групи: 1-ша група — 37 пацієнтів з НАСГ, 2-га група — 53 пацієнти з простим стеатогепатозом, 3-тя група — 65 пацієнтів з ожирінням без стеатозу, 4-та група (контрольна) — 15 пацієнтів з нормальною масою тіла без стеатозу. Проводили дослідження антропометричних параметрів, показників вуглеводного обміну з розрахунком HOMA-IR, цитокінового профілю. Результати. Виявлено підвищення сироваткового вмісту IL-6 та TNF-α у дітей з НАЖХП порівняно з групою контролю (р < 0,05), зниження IL-10 у дітей з НАЖХП (р < 0,05), а також зростання TNF-α/IL-10 (р < 0,05) у дітей з НАСГ порівняно з дітьми з ожирінням без стеатозу. Продемонстровано зростання HOMA-IR у дітей з НАЖХП порівняно з групою контролю та дітьми з ожирінням без стеатозу (р < 0,05). Порогове значення НОМА-IR для діагностики простого стеатозу становило 3,6 (чутливість 78,6 %, специфічність 52,0 %, AUC 0,687), для діагностики НАСГ — 4,9 (чутливість 77,5 %, специфічність 61,7 %, AUC 0,750). Пороговий рівень TNF-α/ІL-10 для діагностики НАСГ становив 0,58 (чутливість 75,7 %, специфічність 65,7 %, AUC 0,716). Висновки. Порогові значення HOMA-IR та TNF-α/ІL-10 демонструють високу діагностичну точність й можуть бути використані для ранньої неїнвазивної діагностики НАЖХП у дітей з ожирінням та диференційної діагностики простого стеатозу і НАСГ.
Background. Insulin resistance indices, in particular homeostatic model assessment of insulin resistance (HOMA-IR), and circulating cytokines are promising markers for noninvasive assessment of hepatocyte damage and metabolic risk in non-alcoholic fatty liver disease (NAFLD) in children and can be used to select pediatric patients at risk of adverse disease course. The purpose was to determine the diagnostic accuracy of insulin resistance markers and circulating cytokines in non-alcoholic fatty liver disease in children. Materials and methods. One hundred and seventy patients aged 6–17 (average of 12.15 ± 2.51) years were included in the study. Hepatic steatosis was determined by transient elastography. Patients were divided into 4 groups according to the presence of hepatic steatosis, non-alcoholic steatohepatitis (NASH) and obesity: group 1 — 37 obese children with NASH, group 2 — 53 patients with simple steatosis, group 3 — 65 obese children without steatosis, group 4 (controls) — 15 patients with normal weight without NAFLD. Anthropometric parameters, carbohydrate metabolism with the HOMA-IR calculation, cytokine profile were evaluated. Results. An increase in serum interleukin (IL) 6 and tumor necrosis factor (TNF) α levels in NAFLD children compared to the control group (p < 0.05), a decrease in IL-10 level in patients with NAFLD (p < 0.05), and an increase in TNFα/IL-10 ratio (p < 0.05) in NASH children compared to obese patients without steatosis were demonstrated. In NAFLD children, an increase of HOMA-IR was found compared to the controls and obese patients without steatosis (p < 0.05). The threshold value of HOMA-IR for the diagnosis of simple steatosis was 3.6 (sensitivity 78.6 %, specificity 52.0 %, area under the curve (AUC) 0.687), for the diagnosis of NASH — 4.9 (sensitivity 77.5 %, specificity 61.7 %, AUC 0.750). The threshold value of TNFα/IL-10 ratio for the diagnosis of NASH was 0.58 (sensitivity 75.7 %, specificity 65.7 %, AUC 0.716). Conclusions. The threshold values of HOMA-IR and TNFα/IL-10 ratio demonstrate high diagnostic accuracy and can be used for early non-invasive diagnosis of NAFLD in obese children and for differential diagnosis of simple steatosis and NASH.
інсулінорезистентність; запалення; діагностична цінність; жирова хвороба печінки; діти
insulin resistance; inflammation; diagnostic accuracy; fatty liver disease; children
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Furthner D., Weghuber D., Dalus C. [et al.]. Nonalcoholic Fatty Liver Disease in Children with Obesity: Narrative Review and Research Gaps. Horm. Res. Paediatr. 2022. Vol. 95(2). P. 167-176. doi:10.1159/000518595.
- Rohm T.V., Meier D.T., Olefsky J.M., Donath M.Y. Inflammation in obesity, diabetes, and related disorders. Immunity. 2022. Vol. 55(1). Р. 31-55. doi: 10.1016/j.immuni.2021.12.013.
- Le Garf S., Nègre V., Anty R., Gual P. Metabolic Fatty Liver Disease in Children: A Growing Public Health Problem. Biomedicines. 2021. Vol. 9(12). Р. 1915. doi: 10.3390/biomedicines9121915.
- EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease / European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), & European Association for the Study of Obesity (EASO). Journal of Hepatology. 2016. Vol. 64(6). P. 1388-1402. https://doi.org/10.1016/j.jhep.2015.11.004.
- Isokuortti E., Zhou Y., Peltonen M. [et al.]. Use of HOMA-IR to diagnose non-alcoholic fatty liver disease: a population-based and inter-laboratory study. Diabetologia. 2017. Vol. 60(10). P. 1873-1882. https://doi.org/10.1007/s00125-017-4340-1.
- El Amrousy D., El-Afify D. Osteocalcin and osteoprotegerin levels and their relationship with adipokines and proinflammatory cytokines in children with nonalcoholic fatty liver disease. Cytokine. 2020. Vol. 135. P. 155215. https://doi.org/10.1016/j.cyto.2020.155215.
- Flisiak-Jackiewicz M., Bobrus-Chociej A., Tarasów E. [et al.] Predictive Role of Interleukin-18 in Liver Steatosis in Obese Children. Canadian Journal оf Gastroenterology & Hepatology. 2018. P. 3870454. https://doi.org/10.1155/2018/3870454.
- Perito E.R., Ajmera V., Bass N.M. [et al.] Association Between Cytokines and Liver Histology in Children with Nonalcoholic Fatty Liver Disease. Hepatology Сommunications. 2017. Vol. 1(7). P. 609-622. https://doi.org/10.1002/hep4.1068.
- Vos M.B., Abrams S.H., Barlow S.E. [et al.]. NASPGHAN Clinical Practice Guideline for the Diagnosis and Treatment of Nonalcoholic Fatty Liver Disease in Children: Recommendations from the Expert Committee on NAFLD (ECON) and the North American Society of Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). Journal of Pediatric Gastroenterology аnd Nutrition. 2017. Vol. 64(2). P. 319-334. https://doi.org/10.1097/MPG.0000000000001482.
- Vajro P., Lenta S., Socha P. [et al.]. Diagnosis of nonalcoholic fatty liver disease in children and adolescents: position paper of the ESPGHAN Hepatology Committee. Journal of Pediatric Gastroenterology аnd Nutrition. 2012. Vol. 54(5). P. 700-713. https://doi.org/10.1097/MPG.0b013e318252a13f.
- de Lédinghen V., Vergniol J., Foucher J. [et al.]. Non-invasive diagnosis of liver steatosis using controlled attenuation parameter (CAP) and transient elastography. Liver International: Official Journal of the International Association for the Study of the Liver. 2012. Vol. 32(6). P. 911-918. https://doi.org/10.1111/j.1478-3231.2012.02820.x.
- Desai N.K., Harney S., Raza R. [et al.]. Comparison of Controlled Attenuation Parameter and Liver Biopsy to Assess Hepatic Steatosis in Pediatric Patients. The Journal of Рediatrics. 2016. Vol. 173. P. 160-164.e1. https://doi.org/10.1016/j.jpeds.2016.03.021.
- Li D.K., Khan M.R., Wang Z. [et al.]. Normal liver stiffness and influencing factors in healthy children: An individual participant data meta-analysis. Liver International: Official Journal of the International Association for the Study of the Liver. 2020. Vol. 40(11). P. 2602-2611. https://doi.org/10.1111/liv.14658.
- Alkhouri N., Sedki E., Alisi A. [et al.]. Combined paediatric NAFLD fibrosis index and transient elastography to predict clinically significant fibrosis in children with fatty liver disease. Liver International: Official Journal of the International Association for the Study of the Liver. 2013. Vol. 33(1). P. 79-85. https://doi.org/10.1111/liv.12024.
- World Health Organization: Growth reference 5-19 years. BMI-for-age (5-19 years). Режим доступу: http://www.who.int/growthref/who2007_bmi_for_age/en/
- Fernández J.R., Redden D.T., Pietrobelli A., Allison D.B. Waist circumference percentiles in nationally representative samples of African-American, European-American, and Mexican-American children and adolescents. J. Pediatr. 2004. Vol. 145(4). P. 439-44.
- Gungor N., Saad R., Janosky J., Arslanian S. Validation of surrogate estimates of insulin sensitivity and insulin secretion in children and adolescents. The Journal of Рediatrics. 2004. Vol. 144(1). P. 47-55. https://doi.org/10.1016/j.jpeds.2003.09.045.
- Shashaj B., Luciano R., Contoli B. [et al.]. Reference ranges of HOMA-IR in normal-weight and obese young Caucasians. Acta Diabetologica. 2016. Vol. 53(2). P. 251-260. https://doi.org/10.1007/s00592-015-0782-4.
- Arellano-Ruiz P., García-Hermoso A., Cavero-Redondo I. [et al.]. Homeostasis Model Assessment cut-off points related to metabolic syndrome in children and adolescents: a systematic review and meta-analysis. European Journal оf Pediatrics. 2019. Vol. 178(12). P. 1813-1822. https://doi.org/10.1007/s00431-019-03464-y.
- Kim A., Yang H.R., Cho J.M. [et al.]. A Nomogram for Predicting Non-Alcoholic Fatty Liver Disease in Obese Children. Pediatric Gastroenterology, Hepatology & Nutrition. 2020. Vol. 23(3). P. 276-285. https://doi.org/10.5223/pghn.2020.23.3.276.
- Prokopowicz Z., Malecka-Tendera E., Matusik P. Predictive Value of Adiposity Level, Metabolic Syndrome, and Insulin Resistance for the Risk of Nonalcoholic Fatty Liver Disease Diagnosis in Obese Children. Canadian Journal оf Gastroenterology & Hepatology. 2018. P. 9465784. https://doi.org/10.1155/2018/9465784.
- Ubiña-Aznar E., Tapia-Ceballos L., Rosales-Zabal J.M. [et al.]. Insulin resistance and the metabolic syndrome are related to the severity of steatosis in the pediatric population with obesity. Revista Espanola de Enfermedades Digestivas: Organo Oficial de la Sociedad Espanola de Patologia Digestiva. 2017. Vol. 109(11). P. 772-777. https://doi.org/10.17235/reed.2017.4898/2017.
- Tarantino G., Conca P., Pasanisi F. [et al.]. Could inflammatory markers help diagnose nonalcoholic steatohepatitis? European Journal оf Gastroenterology & Hepatology. 2009. Vol. 21(5). P. 504-511. https://doi.org/10.1097/MEG.0b013e3283229b40.
- Alaaeddine N., Sidaoui J., Hilal G. [et al.]. TNF-α messenger ribonucleic acid (mRNA) in patients with nonalcoholic steatohepatitis. European Cytokine Network. 2012. Vol. 23(3). P. 107-111. https://doi.org/10.1684/ecn.2012.0313.