Вступ
Кісткова тканина в тісній взаємодії з органами й системами організму людини забезпечує їм опорно-механічну й метаболічну функції. Нормальну життєдіяльність кісток формують основні структури, які входять до їх складу: органічний матрикс (60 %), мінеральний компонент (30 %) і клітини (остеобласти, остеоцити, остеокласти). Основою органічного матриксу є колагенові білки (серед них колаген І типу займає 95 % об’єму), які забезпечують міцність та еластичність кістки, оскільки саме цей вид колагену входить до складу осеїнових волокон, від яких і залежить міцність кісткової тканини. Колагенові структури органічного матриксу не лише виконують опорну функцію, але й позитивно впливають на метаболічні процеси в кістці [1, 2].
Мінеральний компонент кістки містить 98 % усіх неорганічних речовин організму (99 % кальцію, 87 % фосфору, 58 % магнію, 46 % натрію і 20 % мікроелементів). Значний обсяг у кістковій тканині займають кристали гідроксіапатиту (становлять неорганічний компонент кістки) розміром від 10 до 150 нм, які з’єднуються з молекулами колагену через остеонектин. Вони відкладаються спочатку в органічному матриксі у вигляді солей фосфату кальцію. Відомо, що при розвитку остеопорозу змінюються розміри кристалів гідроксіапатиту й порушуються їхні фізичні, механічні й біохімічні властивості. Хімічний склад кісток відрізняється в різні вікові періоди. Зокрема, у кістковій тканині молодих осіб переважають органічні речовини, через що скелет більш гнучкий та еластичний порівняно з особами старшого віку. У людей літнього віку внаслідок порушення фосфорно-кальцієвого обміну й зменшення вмісту органічних речовин кістки стають крихкими, порожнистими й менш щільними [2, 3].
Зниження мінеральної щільності кісткової тканини (МЩКТ) за рахунок порушень у співвідношенні компонентів органічного й мінерального матриксу кістки часто призводить до розвитку остеопорозу і його ускладнень — низькоенергетичних переломів. Зазвичай захворювання маніфестує малотравматичним переломом, найтяжчим видом є перелом проксимального відділу стегнової кістки, який може призводити до зниження середньої тривалості життя на 10–15 %, інвалідизації та смерті пацієнтів [4–7].
Терапія остеопорозу передбачає використання антирезорбтивних і остеоанаболічних лікарських засобів на тлі достатнього споживання кальцію і вітаміну D. Надходження в організм людини кальцію в дозі 1000 мг на добу і вітаміну D (800 МО на добу) є важливою стратегією не тільки лікування остеопорозу, але і його профілактики, особливо в осіб з низькою МЩКТ. Серед кальційвмісних сполук, які позитивно впливають на кісткову тканину, на особливу увагу заслуговує мікрокристалічний гідроксіапатитний комплекс МСНА™ (МСН-Саl™), відомий також як осеїн-гідроксіапатитний комплекс, що є активним регулятором кальцієво-фосфорного обміну. До його складу входить колаген I типу, неколагенові пептиди, а саме інсуліноподібний фактор росту I і II типу (IGF1, IGF2) і трансформуючий фактор росту бета (TGF-β), остеокальцин і гідроксіапатит (у тому числі кальцій, фосфор, магній, цинк, залізо і бор). Інсуліноподібні фактори росту I і II типу здатні впливати на синтез колагену та інших білків кісткової тканини, активувати проліферацію і дозрівання остеобластів і знижувати резорбцію кістки шляхом інгібування клітин-попередників остеокластів, а трансформуючий фактор росту бета бере активну участь у репаративних механізмах при переломах кісток. Остеокальцин відповідає за формування органічного матриксу. Кальцій і фосфор, які входять до складу кристалів гідроксіапатиту (2 : 1), необхідні для мінералізації остеоїду і є будівельним матеріалом кістки. Кальцій у складі гідроксіапатиту знаходиться у високодоступній формі у фізіологічному співвідношенні з фосфором і фіксується в кістці. Повільна абсорбція його в кишечнику зменшує ризик гіперкальційурії, сечокам’яної хвороби й побічних реакцій, характерних для простих солей кальцію [2, 8–10]. У науковій літературі продемонстровано його позитивний вплив при лікуванні хворих на остеопороз, зокрема, за рахунок зниження темпів резорбції кісткової тканини шляхом інгібування клітин — попередників остеокластів, стимуляції проліферації і диференціювання остеобластів, підвищення рівня пропептиду проколагену I типу і активності остеокальцину [11].
Метою клінічного дослідження було оцінити в пацієнтів із системною остеопенією мінеральну щільність кісткової тканини, якість кісткової тканини (Trabecular Bone Score — TBS), маркери ремоделювання кісткової тканини й динаміку вертебрального больового синдрому на тлі прийому мікрокристалічного гідроксіапатиту MCH-Сal™ (OSTEOPRO®) порівняно з комбінацією «карбонат кальцію + вітамін D3».
Матеріали та методи
Дослідження проводилося за обмеженою програмою як відкрите контрольоване паралельне рандомізоване, було виконане на базі відділу клінічної фізіології та патології опорно-рухового апарату Державної установи «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» відповідно до вимог, що висуваються Державним фармакологічним центром МОЗ України до обмежених клінічних досліджень, відповідно до умов Гельсінської декларації і було схвалене комісією з питань етики зазначеної установи (протокол № 10 від 07.07.2021).
Обстежено 40 жінок віком 50–79 років з низькою МЩКТ, які були розподілені на 2 групи: І група — 20 хворих (середній вік — 61,3 ± 7,5 року), які приймали мікрокристалічний гідроксіапатитний комплекс МСНАтм (містить 250 мг протеїнів і 670 мг гідроксіапатиту кальцію, у тому числі 250 мг кальцію, 125 мг фосфору, 4 мг магнію, 64 мкг цинку, 3,9 мкг заліза і 1,4 мкг бору) по 1 таблетці 3 рази на добу протягом 12 міс.; ІІ група — 20 хворих (середній вік — 63,1 ± 6,6 року), які приймали комплекс карбонату кальцію і вітаміну D (1000 мг кальцію і 800 МО вітаміну D3) по 1 таблетці 1 раз на добу протягом 12 міс.
За основними клініко-антропометричними характеристиками, показниками МЩКТ та інтенсивністю больового синдрому пацієнти окремих груп вірогідно не відрізнялися між собою.
До включення в дослідження кожний пацієнт проходив клініко-лабораторне обстеження. У дослідження включалися пацієнти, які відповідали критеріям включення. Критеріями включення в дослідження були: жіноча стать, вік 50–79 років, наявна системна остеопенія за даними двофотонної рентгенівської абсорбціометрії (ДРА) згідно з критеріями ВООЗ (Т-показник на рівні поперекового відділу хребта, проксимального відділу стегнової кістки або шийки стегнової кістки (найнижчий показник) у межах ≥ –2,5 SD і < –1 SD), рівень вітаміну D понад 20 нг/мл, підписана інформована згода й здатність пацієнта до ефективної співпраці. Критеріями невключення були: гіперчутливість до мікрокристалічного гідроксіапатитного комплексу і/або до будь-якого компонента комплексу в анамнезі, остеопороз, рівень вітаміну D нижче за 20 нг/мл, гостра й тяжка хронічна серцева недостатність або порушення функції печінки й нирок.
Використовували ортопедичне й клінічне обстеження, анкетування, лабораторні й інструментальні методи дослідження.
Мінеральну щільність кісткової тканини визначали на рівні поперекового відділу хребта (L1-L4), проксимального відділу й шийки стегнової кістки методом ДРА (прилад Hologic) до терапії і через 6 і 12 міс.
Лабораторне визначення рівня вітаміну D (25(ОН)D) і паратиреоїдного гормону, а також маркерів ремоделювання кісткової тканини, С-кінцевих телопептидів колагену I типу (β-CTx) і N-термінального пропептиду проколагену І типу (P1NP) виконували за допомогою електрохемілюмінесцентного методу на аналізаторі Сobas E-411 (Roche Diagnostics, Німеччина). Усім пацієнтам, включеним у дослідження, також проводили загальний аналіз крові за формулою, загальний аналіз сечі, біохімічний аналіз крові (АЛТ, АСТ, кальцій вільний та іонізований).
У дослідженні були використані анкети: чотирискладова візуальна аналогова шкала болю (ВАШ), опитувальник ECOS-16 (оцінка стану досліджуваного впродовж минулого тижня з огляду на біль у спині, асоційований з остеопорозом) та оцінка якості життя за опитувальником EuroQol-5D.
Подання даних відповідало характеру їх розподілу: при нормальному (за критерієм Шапіро — Вілка) — у вигляді середнього значення й стандартного відхилення (M ± SD), при відмінному від нормального — у вигляді медіани (Me) і міжквартильного розмаху [LQ-UQ]. При нормальному розподілі для перевірки гіпотези про рівність середніх значень двох груп змінної використовували критерій Стьюдента (t). Якщо розподіл змінної не відповідав нормальному, порівняння двох незалежних груп досліджуваної змінної проводили за допомогою тесту Вілкоксона — Манна — Вітні (Z). Відмінності між групами в динаміці спостереження оцінені за допомогою критерію Крускала — Уолліса. Нульова гіпотеза відкидалася при рівні p ≤ 0,05 для кожного з використаних тестів. При аналізі використовували пакети програм Statistiсa 10.0 Copyright© StatSoft, Inc. 1984–2001, Serial number 31415926535897.
Результати
Після проведеного лікування переважна частина обстежених відзначили зменшення інтенсивності больового синдрому, поліпшення функціональних показників повсякденної активності й самообслуговування, а також поліпшення якості життя.
В основній групі отримано вірогідне зниження інтенсивності болю на момент опитування (ВАШ І) через 3 місяці (від 3,0 [1,0–4,0] до 1,0 [0,0–2,0] см, р = 0,04) і 12 місяців терапії (до 1,0 [0,0–3,0] см, р = 0,04), середнього рівня болю (ВАШ ІІ) через 6 місяців (від 3,0 [2,0–3,5] до 2,0 [0,0–3,0] см, р = 0,04) і 12 місяців (до 2,0 [0,0–3,0] см, р = 0,04). У групі порівняння подібних відмінностей не отримано. Також зареєстровано вірогідно нижчі показники інтенсивності болю в основній групі: ВАШ І — через 3 місяці (t = 3,9; p = 0,048), 6 місяців (t = 3,9; p = 0,047) і 12 місяців (t = 4,7; p = 0,038) (рис. 1А), ВАШ ІІ — через 6 місяців (t = 2,85; p = 0,004), ВАШ ІІІ — через 3 місяці (t = 2,14; p = 0,03), 6 місяців (t = 2,07; p = 0,038) і 12 місяців (t = 2,28; p = 0,02).
/37.jpg)
За даними опитувальника ECOS-16, який використовується для оцінки стану досліджуваного впродовж минулого тижня з огляду на біль у спині, асоційований з остеопорозом, зареєстроване вірогідне зменшення в основній групі через 3 місяці (Z = 2,09, p = 0,036) і 12 місяців (Z = 2,78, p = 0,005), вірогідних відмінностей в групі порівняння в динаміці не виявлено, також зареєстровані вірогідно нижчі показники в основній групі через 3 і 6 місяців (рис. 1А).
Якість життя за опитувальником EuroQol-5D у пацієнтів основної групи вірогідно поліпшувалася через 6 місяців (Z = 2,76; p = 0,005) і 12 місяців (Z = 2,01, p = 0,044) на відміну від групи порівняння. Показник опитувальника також був вірогідно нижчим в основній групі через 6 і 12 місяців (рис. 1Б).
Мінеральна щільність кісткової тканини в пацієнтів двох груп вірогідно не відрізнялась на всіх обстежених ділянках упродовж усього обстеження. Також не було зареєстровано відмінностей показників МЩКТ у динаміці в обох групах (табл. 1).
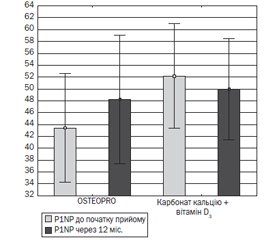
У пацієнтів двох груп не було зареєстровано відмінностей у показниках метаболізму кісткової тканини як на момент включення в дослідження, так і через 12 місяців терапії, за винятком рівня P1NP. Уміст кальцію загального, іонізованого, паратгормону і вітаміну D у сироватці крові в динаміці не змінювався як в основній, так і в групі порівняння і залишався в межах норми.
Дослідження маркерів ремоделювання кісткової тканини показало, що в основній групі рівень маркера формування кісткової тканини вірогідно підвищувався (t = 2,59; p = 0,026) за відсутності змін показника резорбції (рис. 2). У групі порівняння, навпаки, рівень показників формування не змінювався, а показник резорбції зменшувався (t = 2,44; p = 0,037).
Обговорення
Отримані нами результати підтверджують дані наукових джерел щодо впливу осеїн-гідроксіапатитного комплексу не лише на МЩКТ, але й на зменшення інтенсивності болю в хребті й поліпшення якості життя пацієнтів.
Так, у рандомізованому контрольованому проспективному дослідженні іспанських колег із залученням 74 жінок з остеопенією в перименопаузальному періоді, які протягом 6 місяців приймали 1200 мг кальцію карбонату або 1660 мг осеїн-гідроксіапатитного комплексу на добу, було показано, що в пацієнтів, які приймали осеїн-гідроксіапатитний комплекс, інтенсивність болю (за ВАШ) вірогідно знижувалася після 5 і 6 місяців лікування на 41,9 % у спині та на 43,1 % — у колінних суглобах (р < 0,05), що вказує на аналгетичний ефект даного препарату [12]. Оцінка якості життя за опитувальником –SF-36 продемонструвала значно кращі показники для пацієнтів, які приймали осеїн-гідроксіапатитний комплекс, на тлі відсутності змін в осіб, які отримували кальцію карбонат. Отже, вчені підтвердили, що осеїн-гідроксіапатитний комплекс має добрий знеболювальний ефект і покращує якість життя в жінок у перименопаузальному періоді порівняно з прийомом кальцію карбонату, і рекомендують його застосування в пацієнтів з остеопенією й болем у спині та колінних суглобах [12].
Проте найбільший інтерес у науковців викликають дослідження, присвячені вивченню впливу осеїн-гідроксіапатитного комплексу на показники МЩКТ, про що свідчить велика кількість наукових праць [13–17]. Так, у 2020 році були опубліковані результати проспективного порівняльного нерандомізованого відкритого дослідження в Іспанії, що включало 851 жінку в перименопаузальному періоді з низькою МЩКТ. Протягом 3 років одна група пацієнтів отримувала осеїн-гідроксіапатитний комплекс (712 мг кальцію на добу), друга група — карбонат кальцію (1000 мг кальцію на добу). У жінок, які приймали осеїн-гідроксіапатитний комплекс, МЩКТ на рівні L2-L4 залишалась стабільною протягом трирічного періоду спостереження. Показники МЩКТ у пацієнтів, які отримували карбонат кальцію, виявились вірогідно гіршими (p < 0,001). Побічні реакції, зокрема з боку шлунково-кишкового тракту, спостерігалися частіше в групі пацієнтів, які приймали карбонат кальцію, порівняно з тими, хто вживав осеїн-гідроксіапатитний комплекс (7,7 і 2,7 % відповідно; p = 0,001). Отже, для профілактики втрати кісткової маси в жінок у перименопаузальному періоді осеїн-гідроксіапатитний комплекс продемонстрував більшу ефективність і кращу переносимість порівняно з карбонатом кальцію. Вчені відмічають, що оскільки добова доза кальцію була вищою в групі, у якій пацієнти приймали карбонат кальцію, відмінності в результатах дослідження і кращі показники в тих, хто отримував осеїн-гідроксіапатитний комплекс, можуть бути пов’язані саме з осеїновою сполукою в його складі, що чинить позитивний вплив на кісткову тканину [13].
У нашому дослідженні добова доза кальцію також була вищою в групі, у якій пацієнти приймали карбонат кальцію (1000 мг кальцію на добу), порівняно з 750 мг кальцію на добу в групі мікрокристалічного гідроксіапатиту. Відсутність змін у динаміці МЩКТ у жодній групі та вірогідних відмінностей між групами може бути пов’язана з короткою тривалістю дослідження, що тривало 12 місяців.
На сьогодні в літературі дуже мало наукових джерел, присвячених впливу препаратів кальцію на метаболізм кісткової тканини. Так, у дослідженні порівняння впливу осеїн-гідроксіапатитного комплексу й карбонату кальцію на кістковий метаболізм у жінок із сенільним остеопорозом із залученням 120 жінок віком старше 65 років було показано, що в жінок, які отримували осеїн-гідроксіапатитний комплекс (712 мг елементарного кальцію на добу), рівень остеокальцину підвищився через 2 (0,84 ± 3,13 нг/мл) і 3 (1,86 ± 2,82 нг/мл) роки, а в групі жінок, які отримували карбонат кальцію (1000 мг елементарного кальцію на добу), рівень остеокальцину через 2 роки був низьким (0,39 ± 1,39 нг/мл) і залишався приблизно на тому ж рівні через 3 роки (0,31 ± 2,51 нг/мл).
Відмінності між групами порівняння були вірогідними (p < 0,05) як через 2, так і через 3 роки. Зміни МЩКТ у поперековому відділі хребта й шийці стегнової кістки між вихідним рівнем і через 3 роки становили –1,1 і 2,5 % для основної групи і –2,3 і 1,2 % для контрольної групи відповідно. Отже, вчені зробили висновок, що осеїн-гідроксіапатитний комплекс мав більший анаболічний ефект на кісткову тканину, ніж карбонат кальцію, тому призначення жінкам із сенільним остеопорозом комплексу, що містять осеїн-гідроксіапатитний комплекс, є необхідним і більш ефективним порівняно з прийомом карбонату кальцію [14].
У нашому дослідженні також отримані дані щодо анаболічного впливу гідроксіапатитного комплексу на кісткову тканину: зареєстровано збільшення маркера формування кісткової тканини P1NP через 12 місяців терапії на відміну від групи пацієнтів, які приймали комплекси кальцію карбонату й вітаміну D.
Цікаві результати застосування осеїн-гідроксіапатитного комплексу в комбінації з іншими антиостеопоротичними засобами. Так, у відкритому порівняльному дослідженні з включенням 90 жінок у постменопаузальному періоді пацієнти основної групи отримували осеїн-гідроксіапатитний комплекс і ралоксифен, а контрольної групи — ралоксифен і карбонат кальцію. Результати досліджень показали, що в жінок, які приймали протягом 3 років осеїн-гідроксіапатитний комплекс (еквівалент 712 мг кальцію на добу) і ралоксифен, спостерігалось підвищення Т-критерію на 3,8 % і Z-критерію на 7,33 % за даними ультразвукового дослідження фаланг кисті, і ці результати були кращими порівняно з показниками в жінок, які отримували ралоксифен і карбонат кальцію (600 мг на добу) [8, 15].
У метааналізі порівняння впливу осеїн-гідроксіапатитного комплексу і карбонату кальцію, проведеному у 2009 р., було показано, що показники МЩКТ були вірогідно вищими в групі пацієнтів, які отримували осеїн-гідроксіапатитний комплекс (p < 0,00001), і для збереження й поліпшення міцності кісток у пацієнтів із нормальною або зниженою МЩКТ застосування осеїн-гідроксіапатитного комплексу є більш ефективним порівняно з карбонатом кальцію [16, 17].
Подібні результати отримані й у вагітних жінок. Зокрема, було підтверджено позитивний терапевтичний ефект осеїн-гідроксіапатитного комплексу на кісткову тканину, добру переносимість і відсутність побічних реакцій, що робить його важливим для лікування порушень кальцієво-фосфорного балансу у вагітних жінок. Крім того, серед 170 жінок, які приймали осеїн-гідроксіапатитний комплекс протягом вагітності й у післяпологовий період і мали різні скарги, у тому числі на болі в спині й кістках, відзначали зниження або відсутність больового синдрому. Також деякі наукові дані вказують на позитивний вплив осеїн-гідроксіапатитного комплексу на стан вагітних із функціональними м’язовими розладами [11, 18, 19].
Вчені відзначили, що осеїн-гідроксіапатитний комплекс зменшує швидкість резорбції кістки й стимулює окостеніння. Призначення його як монотерапії в пацієнтів з поодинокими й множинними переломами кісток показали скорочення терміну (на 1–4 тижні), необхідного для консолідації шляхом стимуляції утворення кісткової мозолі. Також відомо, що використання осеїн-гідроксіапатитного комплексу у хворих з переломами кісток приводить до зниження в них больового синдрому й активації анаболічних процесів, які сприяють підвищенню МЩКТ [11].
Також вчені вивчали застосування осеїн-гідроксіапатитного комплексу в профілактиці втрати МЩКТ у жінок із хірургічною менопаузою внаслідок двосторонньої оваріектомії протягом 3 років. Показники метаболізму кісткової тканини (гідроксипролін, кістковий ізофермент лужної фосфатази й тартрат-резистентна кисла фосфатаза в сироватці крові та ін.) знизилися як у групі осеїн-гідроксіапатитного комплексу, так і в групі кальцію карбонату порівняно з вихідними значеннями, проте вірогідно більшим це зниження було в групі, яка отримувала осеїн-гідроксіапатитний комплекс [20].
Також у 4-річному ретроспективному дослідженні за участю 237 жінок у постменопаузальному періоді з остеопенією або нормальними показниками МЩКТ було показано, що сполука осеїн-гідроксіапатиту є ефективною і безпечною для профілактики втрати МЩКТ [21]. У ще одному проспективному рандомізованому дослідженні порівнювали вплив осеїн-гідроксіапатитного комплексу (n = 84) і кальцію карбонату (n = 41) на МЩКТ у жінок у постменопаузальному періоді з остеопенією та остеопорозом протягом 12 місяців. Вчені виявили підвищення МЩКТ у групі, що приймала осеїн-гідроксіапатитний комплекс (порівняно з вихідним рівнем приріст МЩКТ через один рік становив +3,28 %) [11, 22–24 ].
Досліджувалась також ефективність осеїн-гідроксіапатитного комплексу в умовах вторинного остеопорозу. Так, доведено, що у хворих на ревматоїдний артрит через один рік після прийому даного препарату спостерігалась вірогідно менша втрата МЩКТ і зменшення болю в суглобах [11, 25]. У пацієнтів з ризиком розвитку остеопорозу через тривале лікування преднізолоном (5–20 мг/д), які приймали мікрокристалічний гідроксіапатитний комплекс, спостерігалося значне зменшення больового синдрому, майже до повної відсутності через 1 рік (р < 0,001), і менша втрата МЩКТ. Застосування мікрокристалічної сполуки в пацієнтів із бронхіальною астмою, які приймали глюкокортикоїди, зменшувало біль у кістках і суглобах і зупиняло посилену втрату МЩКТ, що спровокована прийомом глюкокортикоїдів [11, 26]. У пацієнтів із глюкокортикоїд-індукованим остеопорозом на тлі хронічного активного автоімунного гепатиту, які приймали мікрокристалічну гідроксіапатитну сполуку, протягом 2 років дослідження не було виявлено нових переломів тіл хребців, припинилася втрата МЩКТ у дистальному відділі кісток передпліччя (за даними ДРА) і значно зменшився біль у кістках. Біопсія гребеня клубової кістки цих пацієнтів показала незначне збільшення об’єму трабекулярної кісткової тканини [27].
Отже, велика кількість наукових літературних джерел вказує на переваги застосування мікрокристалічного гідроксіапатитного комплексу, або, як його ще називають, осеїн-гідроксіапатитного комплексу, порівняно зі сполуками кальцію в пацієнтів з остеопенією та остеопорозом або ж з наявними факторами ризику втрати МЩКТ. Вчені припускають, що саме осеїнова сполука, яка входить до складу даного комплексу, забезпечує міцність кістки й сприяє досягненню кращих результатів у профілактиці й лікуванні остеопенії та остеопорозу. Крім того, доведено, що побічні реакції, зокрема з боку шлунково-кишкового тракту, частіше спостерігаються в групі пацієнтів, які приймали карбонат кальцію, порівняно з тими, хто вживав осеїн-гідроксіапатитний комплекс, що доводить його кращу ефективність і безпечність у застосуванні. Дослідження показали, що він не лише зупиняє втрату МЩКТ, але й має добрий знеболювальний ефект і покращує якість життя порівняно з прийомом кальцію карбонату.
Так, широкий діапазон досліджень, зокрема апробація мікрокристалічного гідроксіапатитного комплексу при вторинному остеопорозі, остеопенії, переломах кісток, у вагітних жінок, при болях у суглобах, у спині, в кістках, при сенільному, пери- й постменопаузальному остеопорозі, підтверджує ефективність і безпечність застосування даного препарату й необхідність подальшого вивчення його терапевтичного впливу на кістково-м’язову систему.
Обмеженнями дослідження були його дизайн (одноцентрове), невелика кількість залучених пацієнтів (40 осіб) і тривалість дослідження — 12 місяців, що дозволило виявити вплив на больовий синдром і маркери метаболізму кісткової тканини, проте є недостатнім для висвітлення змін МЩКТ.
Висновки
Застосування остеогенного комплексу OSTEOPRO® є ефективним у лікуванні пацієнтів з остеопенією і дозволить зменшити втрату мінеральної щільності кісткової тканини, знизити больові відчуття, відновити процеси ремоделювання кісткової тканини й покращити якість життя пацієнтів. Тривале використання остеогенного комплексу OSTEOPRO® (12 місяців) є безпечним і не викликає змін у показниках клінічних лабораторних досліджень та за даними ультразвукового дослідження нирок.
Подяка. Автори вшановують пам’ять та висловлюють подяку своєму колезі та учителю проф. В.В. Поворознюку (22.10.1954–12.06.2021) за розробку концепції та дизайну дослідження.
Конфлікт інтересів та інформація про фінансування. Дослідження було виконано за фінансової підтримки ТОВ «УА «Про-Фарма».
Інформація про внесок кожного автора в підготовку статті. Григор’єва Н.В. — розробка концепції і дизайну дослідження, аналіз отриманих даних, корекція тексту; Бистрицька М.А. — збір матеріалу, аналіз отриманих даних, написання й редагування статті; Мусієнко А.С. — збір матеріалу, аналіз отриманих даних, написання й редагування статті; Дубецька Г.С. — огляд літератури, збір та обробка матеріалів; Заверуха Н.В. — збір матеріалу, аналіз отриманих даних; Солоненко Т.Ю. — збір та обробка матеріалів.
Отримано/Received 12.10.2022
Рецензовано/Revised 23.11.2022
Прийнято до друку/Accepted 02.12.2022
/38.jpg)

/37.jpg)
/38_2.jpg)