Журнал «Боль. Суставы. Позвоночник» Том 13, №2, 2023
Вернуться к номеру
Клінічне значення адипокінового профілю (лептину й адипонектину) у хворих на подагру
Авторы: Орлова І.В., Станіславчук М.А.
Вінницький національний медичний університет імені М.І. Пирогова, м. Вінниця, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
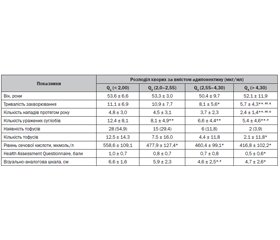
Актуальність. Останнім часом у літературних джерелах з’являються численні дані щодо можливого впливу лептину й адипонектину на розвиток і прогресування ревматичних захворювань. Досліджено, що зростання рівня лептину й адипонектину асоціюється з гіперурикемією при різних патологічних станах. Проте дані стосовно адипокінового профілю, а саме рівнів лептину й адипонектину, у хворих на подагру обмежені. Мета: вивчити вміст лептину й адипонектину в сироватці хворих на подагру залежно від перебігу захворювання, а також оцінити їх зв’язок з клінічними особливостями перебігу захворювання. Матеріали та методи. Обстежено 151 хворого на подагру (усі чоловіки, середній вік 52,4 ± 9,2 року), контрольну групу становив 31 практично здоровий чоловік того ж віку. Результати. У хворих на подагру виявили вищий рівень лептину, нижчий рівень адипонектину і менший показник співвідношеня адипонектин/лептин (lg А/Л) порівняно з показниками практично здорових осіб. Гіперлептинемію (рівень лептину > 5,91 нг/мл) виявлено в 49,7 % осіб, гіпоадипонектинемію (рівень адипонектину < 3,61 мкг/мл) — у 66,9 % і дисадипокінемію (lg А/Л < 3,2) — у 82,1 %. Частота гіперлептинемії, гіпоадипонектинемії та дисадипокінемії була вірогідно вищою у хворих на подагру з наявністю тофусів (у 3,9; 1,7 і 1,4 раза відповідно). Явище дисадипокінемії асоціювалось зі збільшенням тяжкості захворювання — більшою кількістю уражених суглобів, більшою частотою загострень подагричного артриту протягом року, більшою вираженістю больового синдрому за візуально-аналоговою шкалою, вищим рівнем сечової кислоти сироватки крові (r = –0,23; r = –0,24; r = –0,35; r = –0,44 відповідно; р < 0,01 для усіх показників). Висновки. У хворих на подагру відзначається порушення адипокінового профілю: підвищення рівня лептину, зниження рівня адипонектину та зниження їх співвідношення (lg А/Л). Наростання дисбалансу адипокінів асоціюється з тяжчим перебігом захворювання і може розглядатися як несприятливий прогностичний фактор.
Background. Recently, there is a lot of data on the role of leptin and adiponectin in the development and progression of rheumatic diseases. It has been studied that the increase in the level of leptin and adiponectin is associated with hyperuricemia in various pathological conditions. Data on the adipokine profile, leptin and adiponectin levels in patients with gout are limited. The purpose was to study the content of leptin and adiponectin in the serum of patients with gout depending on the course of the disease, as well as to evaluate their diagnostic value. Materials and methods. We examined 151 patients with gout (100 % men, average age 52.4 ± 9.2 years). The control group consisted of 31 practically healthy men of the same age. Results. Patients with gout had higher levels of leptin, lower levels of adiponectin and lower ratio adiponectin/leptin (lg A/L) than practically healthy men. Hyperleptinemia (leptin level > 5.91 ng/ml) was found in 49.7 % of subjects, hypoadiponectinemia (adiponectin level < 3.61 μg/ml) — in 66.9 % and dysadipokinemia (lg A/L < 3.2) — in 82.1 %. The frequency of hyperleptinemia, hypoadiponectinemia, and dysadipokinemia was significantly higher in patients with tophi in 3.9; 1.7 and 1.4 times, respectively. The phenomenon of dysadipokinemia associated with an increase in the severity of the disease — a greater number of affected joints, a greater frequency of exacerbations of gouty arthritis during the year, the severity of the pain syndrome according to the VAS, a higher level of uric acid in the blood serum (r = –0.23; r = –0.24; r = –0.35; r = –0.44; p < 0.01 for all indices). Conclusions. Patients with gout have a violation of the adipokine profile: an increase in the level of leptin, a decrease in the level of adiponectin and a decrease in their ratio (lg A/L). An increasing imbalance of adipokines is associated with a more severe course of the disease and can be considered could serve as a prognostic factor.
подагра; лептин; адипонектин; співвідношення адипонектину/лептину
gout; leptin; adiponectin, adiponectin/leptin ratio
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Dehlin M., Jacobsson L., Roddy E. Global epidemiology of gout: prevalence, incidence, treatment patterns and risk factors. Nat. Rev. Rheumatol. 2020. 16(7). 380-390. doi: 10.1038/s41584-020-0441-1.
- Singh J.A., Gaffo A. Gout epidemiology and comorbidities. Semin. Arthritis Rheum. 2020. 50(3S). 11-16. doi: 10.1016/j.semarthrit.2020.04.008.
- Zhang J., Jin C., Ma B. et al. Global, regional and national burdens of gout in the young population from 1990 to 2019: a population-based study. RMD Open. 2023. 9(2). e003025. doi: 10.1136/rmdopen-2023-003025. PMID: 37094981; PMCID: PMC10152042.
- Chandratre P., Mallen C., Richardson J. et al. Health-related quality of life in gout in primary care: Baseline fin–dings from a cohort study. Semin. Arthritis Rheum. 2018. 48(1). 61-69. doi: 10.1016/j.semarthrit.2017.12.005.
- Tsioufis C., Kyvelou S., Dimitriadis K. et al. The diverse associations of uric acid with low-grade inflammation, adiponectin and arterial stiffness in never-treated hypertensives. J. Hum. Hypertens. 2011. 25(9). 554-9. doi: 10.1038/jhh.2010.98.
- Lubawy M., Blacha A., Nowicki M., Deja T., Wałkowski K., Formanowicz D. Ghrelin and Leptin among Patients with Urolithiasis with Concomitant Hyperuricemia and Metabolic Syndrome. Biomedicines. 2023. 11(2). 285. doi: 10.3390/biomedicines11020285.
- Xie C., Chen Q. Adipokines: New Therapeutic Target for Osteoarthritis? Curr. Rheumatol. Rep. 2019. 21(12). 71. doi: 10.1007/s11926-019-0868-z.
- Orellana C., Calvet J., Berenguer-Llergo A. et al. Synovial Adiponectin Was More Associated with Clinical Severity than Synovial Leptin in Women with Knee Osteoarthritis. Cartilage. 2021 Dec. 13 (1_suppl.). 1675S-1683S. doi: 10.1177/1947603520904776.
- Bustos Rivera-Bahena C., Xibillé-Friedmann D.X., González-Christen J., Carrillo-Vázquez S.M., Montiel-Hernández J.L. Peripheral blood leptin and resistin levels as clinical activity biomarkers in Mexican Rheumatoid Arthritis patients. Reumatol. Clin. 2016. 12(6). 323-326. doi: 10.1016/j.reuma.2015.11.011.
- Wang Z., Huang X., Ye X., Li X., Wei J. Roles of leptin on the key effector cells of rheumatoid arthritis. Immunol. Lett. 2021. 233. 92-96. doi: 10.1016/j.imlet.2021.02.008.
- Caso F., Postiglione L., Covelli B. et al. Pro-inflammatory adipokine profile in psoriatic arthritis: results from a cross-sectional study comparing PsA subset with evident cutaneous involvement and subset “sine psoriasis”. Clin. Rheumatol. 2019. 38(9). 2547-2552. doi: 10.1007/s10067-019-04619-w.
- Neogi T., Jansen T.L., Dalbeth N. et al. 2015 Gout classification criteria: an American College of Rheumato–logy/European League Against Rheumatism collaborative initiative. Ann. Rheum. Dis. 2015. 74(10). 1789-98. doi: 10.1136/annrheumdis-2015-208237.
- Vega G.L., Grundy S.M. Metabolic risk susceptibi–lity in men is partially related to adiponectin/leptin ratio. J. Obes. 2013. 2013. 409679. doi: 10.1155/2013/409679.
- Kim J.Y., Ahn S.V., Yoon J.H. et al. Prospective study of serum adiponectin and incident metabolic syndrome: the ARIRANG study. Diabetes Care. 2013. 36(6). 1547-53. doi: 10.2337/dc12-0223.
- Tian Y., Wang S., Ma Y., Lim G., Kim H., Mao J. Leptin enhances NMDA-induced spinal excitation in rats: A functional link between adipocytokine and neuropathic pain. Pain. 2011. 152(6). 1263-1271. doi: 10.1016/j.pain.2011.01.054.
- Hu F., Cui Y., Guo R. et al. Spinal leptin contri–butes to the development of morphine antinociceptive to–lerance by activating the STAT3-NMDA receptor pathway in rats. Mol. Med. Rep. 2014. 10(2). 923-30. doi: 10.3892/mmr.2014.2250.
- Fatel E.C.S., Rosa F.T., Simão A.N.C., Dichi I. Adipokines in rheumatoid arthritis. Adv. Rheumatol. 2018. 58(1). 25. doi: 10.1186/s42358-018-0026-8.
- Dervišević A., Resić H., Sokolović Š. et al. Leptin is associated with disease activity but not with anthropometric indices in rheumatoid arthritis patients. Arch. Med. Sci. 2018 Aug. 14(5). 1080-1086. doi: 10.5114/aoms.2017.65080. PMID: 30154891; PMCID: PMC6111354.
- Rivera-Bahena C.B., Xibillé-Friedmann D.X., González-Christen J., Carrillo-Vázquez S.M., Montiel-Hernández J.L. Peripheral blood leptin and resistin levels as clinical activity biomarkers in Mexican Rheumatoid Arthritis patients. Reumatol. Clin. 2016. 12(6). 323-326. doi: 10.1016/j.reuma.2015.11.011.
- Samara A., Herbeth B., Aubert R. et al. Sex-dependent associations of leptin with metabolic syndrome-related variables: the Stanislas study. Obesity (Silver Spring). 2010. 18(1). 196-201. doi: 10.1038/oby.2009.156.
- D’Elia L., Giaquinto A., Cappuccio F.P. et al. Circulating leptin is associated with serum uric acid level and its tubular reabsorption in a sample of adult middle-aged men. J. Endocrinol. Invest. 2020. 43(5). 587-593. doi: 10.1007/s40618-019-01140-4.
- Yu Y., Yang J., Fu S., Xue Y., Liang M., Xuan D. et al. Leptin Promotes Monosodium Urate Crystal-Induced Inflammation in Human and Murine Models of Gout. J. Immunol. 2019. 202(9). 2728-2736. doi: 10.4049/jimmunol.1801097.
- Clockaerts S., Bastiaansen-Jenniskens Y.M., Feijt C. et al. Cytokine production by infrapatellar fat pad can be stimulated by interleukin 1β and inhibited by peroxisome proliferator activated receptor α agonist. Ann. Rheum. Dis. 2012. 71(6). 1012-8. doi: 10.1136/annrheumdis-2011-200688.
- Abella V., Scotece M., Conde J., Pino J., Gonzalez-Gay M.A., Gómez-Reino J.J. et al. Leptin in the interplay of inflammation, metabolism and immune system disorders. Nat. Rev. Rheumatol. 2017. 13(2). 100-109. doi: 10.1038/nrrheum.2016.209.
- Frühbeck G., Catalán V., Rodríguez A., Gómez-Ambrosi J. Adiponectin-leptin ratio: A promising index to estimate adipose tissue dysfunction. Relation with obesity-associated cardiometabolic risk. Adipocyte. 2018. 7. 5762. doi: 10.1080/21623945.2017.1402151.