Журнал «Боль. Суставы. Позвоночник» Том 13, №4, 2023
Вернуться к номеру
Мінеральна щільність та якість кісткової тканини в пацієнтів із сечокам’яною хворобою
Авторы: O.D. Nikitin (1), O.I. Nishkumay (1), Mike K.S. Chan (2), Michelle B.F. Wong (2), A.V. Korytskyi (1), I.A. Kordubailo (3), E.I. Levenko (4), Z.V. Lysak (4), S.M. Dubynska (4)
(1) - Bogomolets National Medical University, Kyiv, Ukraine
(2) - European Wellness Academy, Edenkoben, Germany
(3) - Kyiv Regional Clinical Hospital, Kyiv, Ukraine
(4) - Medical Centre “Arensia Exploratory Medicine”, Kyiv, Ukraine
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
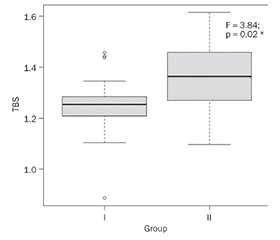
Актуальність. В умовах динаміки старіння населення світу провідні місця в структурі вікових захворювань посідає остеопороз, що характеризується низькоенергетичними переломами внаслідок зниження мінеральної щільності кісткової тканини (МЩКТ). Однією з причин остеопорозу є недостатнє споживання кальцію через страх утворення сечокам’яної хвороби (СКХ). Метою дослідження було проведення порівняльної оцінки МЩКТ, показника якості трабекулярної кістки (Trabecular Bone Score (TBS)) залежно від наявності СКХ. Матеріали та методи. У дослідженні взяли участь 80 пацієнтів: 14 чоловіків (17,5 %) та 66 жінок (82,5 %). У I групу увійшли 48 осіб із СКХ (34 (70,83 %) жінки, 14 (29,17 %) чоловіків, середній вік 55,5 (ВІ 51,5–62,5) року), у ІІ групу — 32 пацієнти без СКХ (31 (96,88 %) жінка, 1 (3,12 %) чоловік, медіана віку 63,2 (ВІ 58,8–67,4) року). Аналізували показники двохенергетичної рентгенівської абсорбціометрії (прилад Hologic Discovery). Для оцінки TBS використовували метод TBS iNsight, розроблений Medimaps (Бордо, Франція). Результати. Виявлення СКХ зросло з 16,25 % (на підставі діагностованого в анамнезі захворювання) до 49,25 % (після додатково проведеного ультразвукового дослідження). Показники МЩКТ у хворих на нефролітіаз не відрізнялися від параметрів осіб без СКХ, тоді як TBS був достовірно нижчим. Висновки. Нефролітіаз є недостатньо діагностованою проблемою, особливо при скринінгу МЩКТ. У пацієнтів із СКХ TBS достовірно нижчий порівняно з показниками осіб без нефролітіазу. Отримані дані потребують детального вивчення можливих причин і зв’язків порушень МЩКТ у хворих на нефролітіаз.
Background. With the dynamics of the aging of the global population, leading places in the structure of age-related diseases are occupied by osteoporosis (OP), which is characterized by low-energy fractures due to decrease of bone mineral density (BMD). One of ОР reasons is insufficient calcium intake due to the fear of kidney stones disease (KSD) formation. The aim of the research was the assessment of the BMD, Trabecular Bone Score (TBS) of patients depending on KSD. Materials and methods. Eighty patients took part in the study, 14 men (17.5 %) and 66 women (82.5 %). First group consisted of 48 patients with KSD (women — 34 (70.83 %), men — 14 (29.17 %), average age 55.5 [IQR 51.5–62.5] years), second one included 32 subjects (women 31 (96.88 %), men — 1 (3.12 %), median age 63.2 [IQR 58.8–67.4] years) without nephrolithiasis. We analyzed parameters of dual energy X-ray absorptiometry (Hologic Discovery device). The TBS iNsight method was used to assess the TBS. Results. The detection of KSD increased from 16.25 % (on the basis of the disease diagnosed in the anamnesis) to 49.25 % (after additional ultrasound examination). BMD indices in patients with nephrolithiasis did not differ from the parameters of people without CKD, while TBS was significantly lower. Conclusions. Nephrolithiasis is an underdiagnosed problem, especially in BMD screening. In patients with KSD, TBS a significant lower compare with subjects without nephrolithiasis. The obtained data require a detailed study of the possible causes and connections of BMD disorders in patients with KSD.
сечокам’яна хвороба; остеопенія; остеопороз; мінеральна щільність кісткової тканини; показник якості трабекулярної кістки
kidney stones disease; osteopenia; osteoporosis; bone mineral density; Trabecular Bone Score
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Rudnicka E., Napierała P., Podfigurna A., Męczekalski B., Smolarczyk R., Grymowicz M. The World Health Organization (WHO) approach to healthy ageing. Maturitas. 2020. 139. 6-11. doi: 10.1016/j.maturitas.2020.05.018.
- Willers C., Norton N., Harvey N.C. et al. Osteoporosis in Europe: a compendium of country-specific reports. Arch. Osteoporos. 2022. 17(1). 23. doi: 10.1007/s11657-021-00969-8.
- Migliorini F., Giorgino R., Hildebrand F. et al. Fragility Fractures: Risk Factors and Management in the Elderly. Medicina (Kaunas). 2021. 57(10). 1119. doi: 10.3390/medicina57101119.
- Barcelos A., Gonçalves J., Mateus C., Canhão H., Rodrigues A.M. Costs of incident non-hip osteoporosis-related fractures in postmenopausal women from a payer perspective. Osteoporos. Int. 2023. 34(12). 2111-2119. doi: 10.1007/s00198-023-06881-w.
- Balk E.M., Adam G.P., Langberg V.N. et al. Global dietary calcium intake among adults: a systematic review. Osteoporos. Int. 2017. 28. 3315-3324. doi: 10.1007/s00198-017-4230-x.
- Geraghty R.M., Davis N.F., Tzelves L. et al. Best Practice in Interventional Management of Urolithiasis: An Update from the European Association of Urology Guidelines Panel for Urolithiasis 2022. Eur. Urol. Focus. 2023. 9(1). 199-208. doi: 10.1016/j.euf.2022.06.014.
- National Institute for Health and Care Excellence NICE: Clinical Guideline [CG146] — Osteoporosis: assessing the risk of fragility fracture. 2012. Available from: https://www.nice.org.uk/guidance/cg146.
- Kanis J.A., Johansson H., Harvey N.C., McCloskey E.V. A brief history of FRAX. Arch. Osteoporos. 2018. 13(1). 118. doi: 10.1007/s11657-018-0510-0.
- Hans D., Goertzen A.L., Krieg M.A., Leslie W.D. Bone microarchitecture assessed by TBS predicts osteoporotic fractures independent of bone density: the Manitoba study. J. Bone Miner. Res. 2011. 26(11). 2762-2769. doi: 10.1002/jbmr.499.
- Li Z., Li L., Zheng J. et al. Associations between lumbar bone mineral density, serum 25-hydroxyvitamin D and history of kidney stones in adults aged 30–69 years in the USA (NHANES 2011–2018). BMJ Open. 2023. 13(5). e070555. doi: 10.1136/bmjopen-2022-070555.
- Abdalbary M., Chishti E., Shakhashiro M. et al. Impact of urinary calcium excretion on kidney, bone, and cardiovascular systems in patients with bone biopsy proven osteoporosis: a longitudinal long-term follow-up study. Osteoporos. Int. 2023. 34(4). 763-774. doi: 10.1007/s00198-023-06686-x.
- Dent E.L., Ryan M.J. Fifty years of impact on treating bone disease: a commentary on Gasser et al. Clin. Sci. (London). 2022. 136(22). 1657-1659. doi: 10.1042/CS20220040.
- Tostivint I.N., Castiglione V., Alkouri R. et al. How useful is an oral calcium load test for diagnosing recurrent calcium stone formers? Urolithiasis. 2022. 50(5). 577-587. doi: 10.1007/s00240-022-01355-w.
- Peerapen P., Thongboonkerd V. Kidney Stone Prevention. Adv. Nutr. 2023. 14(3). 555-569. doi: 10.1016/j.advnut.2023.03.002.
- Abdalbary M., Sobh M., Elnagar S. et al. Management of osteoporosis in patients with chronic kidney disease. Osteoporos. Int. 2022. 33(11). 2259-2274. doi: 10.1007/s00198-022-06462-3.
- Shevroja E., Reginster J.Y., Lamy O. et al. Update on the clinical use of trabecular bone score (TBS) in the management of osteoporosis: results of an expert group meeting organized by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO), and the International Osteoporosis Foundation (IOF) under the auspices of WHO Collaborating Center for Epidemiology of Musculoskeletal Health and Aging. Osteoporos. Int. 2023. 34(9). 1501-1529. doi: 10.1007/s00198-023-06817-4.
- Rampersad C., Whitlock R.H., Leslie W.D. et al. Trabecular bone score in patients with chronic kidney disease. Osteoporos. Int. 2020. 31(10). 1905-1912. doi: 10.1007/s00198-020-05458-1.
- Kužma M., Jackuliak P., Killinger Z., Payer J. Parathyroid Hormone-Related Changes of Bone Structure. Physiol. Res. 2021. 70 (Suppl. 1). S3-S11. doi: 10.33549/physiolres.934779.
- Brandenburg V., Ketteler M. Vitamin D and Se–condary Hyperparathyroidism in Chronic Kidney Di–sease: A Critical Appraisal of the Past, Present, and the Future. Nutrients. 2022. 14(15). 3009. doi: 10.3390/nu14153009.
- Smout D., Jørgensen H.S., Cavalier E., Evenepoel P. Clinical utility of bone turnover markers in patients with chronic kidney disease. Curr. Opin. Nephrol. Hypertens. 2022. 31(4). 332-338. doi: 10.1097/MNH.0000000000000798.
- Ganesan C., Thomas I.C., Romero R. et al. Osteoporosis, Fractures, and Bone Mineral Density Screening in Veterans with Kidney Stone Disease. J. Bone Miner. Res. 2021. 36(5). 872-878. doi: 10.1002/jbmr.4260.
- Misael da Silva A.M., dos Reis L.M., Pereira R.C. et al. Bone involvement in idiopathic hypercalciuria. Clin. Nephrol. 2002. 57(3). 183-191. doi: 10.5414/cnp57183.