Международный эндокринологический журнал Том 20, №2, 2024
Вернуться к номеру
Ліпідний обмін у пацієнтів із хронічним гепатитом С, неалкогольною жировою хворобою печінки й ожирінням під впливом лікування
Авторы: M.A. Derbak, N.V. Lizanets, O.T. Hanych, V.V. Mashura, H.Y. Mashura, O.V. Ustych, L.M. Rostoka
State Higher Educational Institution “Uzhhorod National University”, Uzhhorod, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
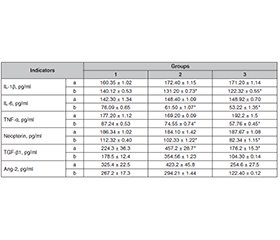
Актуальність. У хворих із високими стадіями фіброзу печінки після повної елімінації вірусу гепатиту С може спостерігатися прогресування фіброзу печінки й ожиріння. Мета: вивчити вплив противірусної терапії на показники ліпідного обміну в осіб із хронічним гепатитом С (ХГС), поєднаним із неалкогольною жировою хворобою печінки (НАЖХП). Матеріали та методи. Під спостереженням знаходилось 82 хворі: 56 пацієнтів із ХГС, поєднаним із НАЖХП, і 26 осіб із ХГС. Учасники розділені на три групи: першу (n = 23) — пацієнти з ХГС, НАЖХП та ожирінням, другу (n = 33) — особи з ХГС, НАЖХП і підвищеною масою тіла, третю (n = 26) — хворі на ХГС із нормальною масою тіла. Усім пацієнтам проведено визначення біохімічних показників крові та загального холестерину, ліпопротеїнів низької (ЛПНЩ), дуже низької (ЛПДНЩ) та високої щільності (ЛПВЩ), тригліцеридів та цитокінів ангіопоетину-2, трансформуючого фактора росту β1, фактора некрозу пухлини α і неоптерину, інтерлейкіну-6. Ступінь фіброзу та стеатозу печінки визначено за допомогою FibroMax. Хворі отримували софосбувір 400 мг, даклатасвір 60 мг 1 раз на добу протягом 12 тижнів. Результати. Установлено, що 8 хворих мали фіброз печінки F3–4, 11 осіб — F2–3, 23 — F1–2, а 37 осіб — стадію F0–1. Стійку вірусологічну відповідь отримано в 95,1 % хворих на ХГС. У 4,9 % пацієнтів, які мали прогресуючі стадії фіброзу печінки та ожиріння або підвищену масу тіла, відповіді не отримано. Після проведеного лікування незначне підвищення рівня холестерину ЛПВЩ зареєстровано в 61,1 % хворих третьої групи, 50 % — другої і тільки в 31,2 % — першої групи. Уміст загального холестерину мав тенденцію до підвищення в першій та другій групах, а в третій залишався без змін. Хоча зміни рівнів ЛПНЩ та ЛПДНЩ були статистично значущі, однак за абсолютними значеннями вони невеликі. У 62,5 % осіб із ХГС і супутньою НАЖХП, які мали ожиріння або підвищену масу тіла та фіброз F3–4, навіть після повної елімінації вірусу гепатиту С рівні ангіопоетину-2, трансформуючого фактора росту β1 залишаються високими та позитивно корелюють із ступенем стеатозу та стадією фіброзу печінки. Висновки. Після успішної елімінації вірусу гепатиту С у пацієнтів, які мають супутню неалкогольну жирову хворобу печінки, фіброз F3–4 та підвищену масу тіла, реєструються порушення ліпідного обміну.
Background. In patients with advanced stages of liver fibrosis, progression of liver fibrosis and obesity may be observed after complete elimination of hepatitis C virus. The aim of the research was to study the impact of antiviral therapy on lipid metabolism indicators in patients with chronic hepatitis C (CHC) combined with non-alcoholic fatty liver disease (NAFLD). Materials and methods. Eighty-two patients were under observation, 56 with CHC combined with NAFLD and 26 with CHC. They were divided into three groups: first one (n = 23) — patients with CHC with NAFLD and obesity, second (n = 33) — participants with CHC, NAFLD and overweight, third group (n = 26) — CHC patients with normal body weight. All patients underwent determination of blood lipid spectrum and cytokines Ang-2, TGF-β1, TNF-α and neopterin, IL-6. The degree of liver fibrosis and steatosis was determined using FibroMax. Patients received sofosbuvir 400 mg, daclatasvir 60 mg once a day for 12 weeks. Results. The study found that 8 patients had liver fibrosis F3–4, 11 people — F2–3, 23 — F1–2, and 37 people — F0–1. Sustained virological response was achieved in 95.1 % of patients with CHC. No response was received in 4.9 % of patients who had advanced stages of liver fibrosis and obesity or increased body weight. After the treatment, a slight increase in the level of high-density lipoprotein cholesterol was registered in 61.1 % of patients in group 3, 50 % in group 2, and only in 31.2 % of patients in group 1. Content of total cholesterol tended to increase in patients of groups 1 and 2 and remained unchanged in group 3. Although the changes in the levels of low- and very low-density lipoprotein were statistically significant, they were not large in terms of absolute values. In 62.5 % of CHC patients with concomitant NAFLD who had obesity or increased body weight and F3–4 fibrosis, even after complete elimination of the virus, the levels of Ang-2 and TGF-β1 remain high and positively correlate with the degree of steatosis and the stage of liver fibrosis. Conclusions. After the successful elimination of the hepatitis C virus, lipid metabolism disorders are registered in patients with concomitant non-alcoholic fatty liver disease, F3–4 fibrosis and increased body weight.
гепатит C; неалкогольна жирова хвороба печінки; стеатоз; фіброз; ожиріння; ліпідний обмін; противірусна терапія
hepatitis C; non-alcoholic fatty liver disease; steatosis; fibrosis; obesity; lipid metabolism; antiviral therapy
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- El-Shabrawi M.H.F., Kamal N.M., Mogahed E.A., Elhusseini M.A., Aljabri M.F. Perinatal transmission of hepatitis C virus: an update. Arch. Med. Sci. 2019 Mar 15. 16(6). 1360-1369. doi: 10.5114/aoms.2019.83644.
- Salomone F., Petta S., Micek A., Pipitone R.M., Distefano A. et al. Hepatitis C virus eradication by direct antiviral agents abates oxidative stress in patients with advanced liver fibrosis. Liver Int. 2020 Nov. 40(11). 2820-2827. doi: 10.1111/liv.14608.
- Hernández-Bartolomé Á., López-Rodríguez R., Borque M.J., González-Moreno L., Real-Martínez Y. et al. Angiopoietin-2/angiopoietin-1 as non-invasive biomarker of cirrhosis in chronic hepatitis C. World J. Gastroenterol. 2016 Nov 28. 22(44). 9744-9751. doi: 10.3748/wjg.v22.i44.9744.
- Suda G., Sakamoto N. Recent advances in the treatment of hepatitis C virus infection for special populations and remaining problems. J. Gastroenterol. Hepatol. 2021 May. 36(5). 1152-1158. doi: 10.1111/jgh.15189.
- Tachi Y., Hirai T., Miyata A., Ohara K., Iida T. et al. Progressive fibrosis significantly correlates with hepatocellular carcinoma in patients with a sustained virological response. Hepatol. Res. 2015 Jan. 45(2). 238-46. doi: 10.1111/hepr.12331.
- Russo F.P., Zanetto A., Gambato M., Bortoluzzi I., Al Zoairy R. et al. Hepatitis C virus eradication with direct-acting antiviral improves insulin resistance. J. Viral Hepat. 2020 Feb. 27(2). 188-194. doi: 10.1111/jvh.13215.
- Li J., Zhang T., Gordon S.C., Rupp L.B., Trudeau S. et al.; CHeCS Investigators. Impact of sustained virologic response on risk of type 2 diabetes among hepatitis C patients in the United States. J. Viral Hepat. 2018 Aug. 25(8). 952-958. doi: 10.1111/jvh.12887.
- Salomone F., Catania M., Montineri A., Bertino G., Godos J. et al. Hepatitis C virus eradication by direct antiviral agents improves glucose tolerance and reduces post-load insulin resistance in nondiabetic patients with genotype 1. Liver Int. 2018 Jul. 38(7). 1206-1211. doi: 10.1111/liv.13669.
- Thompson A.J., Patel K., Chuang W.L., Lawitz E.J., Rodriguez-Torres M. et al.; ACHIEVE-1 and ACHIEVE-2/3 Study Teams. Viral clearance is associated with improved insulin resistance in genotype 1 chronic hepatitis C but not genotype 2/3. Gut. 2012 Jan. 61(1). 128-34. doi: 10.1136/gut.2010.236158.
- Stine J.G., Wynter J.A., Niccum B., Kelly V., Caldwell S.H., Shah N.L. Effect of Treatment with Direct Acting Antiviral on Glycemic Control in Patients with Diabetes Mellitus and Chro–nic Hepatitis C. Ann. Hepatol. 2017 Mar-Apr. 16(2). 215-220. doi: 10.5604/16652681.1231581.
- Chaudhury C.S., Sheehan J., Chairez C., Akoth E., Gross C. et al. No Improvement in Hemoglobin A1c Following Hepatitis C Viral Clearance in Patients With and Without HIV. J. Infect. Dis. 2017 Dec 27. 217(1). 47-50. doi: 10.1093/infdis/jix517.
- Doyle M.A., Galanakis C., Mulvihill E., Crawley A., Cooper C.L. Hepatitis C Direct Acting Antivirals and Ribavirin Modify Lipid but not Glucose Parameters. Cells. 2019 Mar 15. 8(3). 252. doi: 10.3390/cells8030252.
- Meissner E.G., Lee Y.J., Osinusi A., Sims Z., Qin J. et al. Effect of sofosbuvir and ribavirin treatment on peripheral and hepatic li–pid metabolism in chronic hepatitis C virus, genotype 1-infected patients. Hepatology. 2015 Mar. 61(3). 790-801. doi: 10.1002/hep.27424.
- Rao G.A., Pandya P.K. Statin therapy improves sustained virologic response among diabetic patients with chronic hepatitis C. Gastroenterology. 2011 Jan. 140(1). 144-52. doi: 10.1053/j.gastro.2010.08.055.
- Atsukawa M., Tsubota A., Kondo C., Itokawa N., Narahara Y. et al. Combination of fluvastatin with pegylated interferon/ribavirin therapy reduces viral relapse in chronic hepatitis C infected with HCV genotype 1b. J. Gastroenterol. Hepatol. 2013 Jan. 28(1). 51-6. doi: 10.1111/j.1440-1746.2012.07267.x.
- Harrison S.A., Rossaro L., Hu K.Q., Patel K., Tillmann H. et al. Serum cholesterol and statin use predict virological response to peginterferon and ribavirin therapy. Hepatology. 2010 Sep. 52(3). 864-74. doi: 10.1002/hep.23787.
- Noureddin M., Wong M.M., Todo T., Lu S.C., Sanyal A.J., Mena E.A. Fatty liver in hepatitis C patients post-sustained virological response with direct-acting antivirals. World J. Gastroenterol. 2018 Mar 21. 24(11). 1269-1277. doi: 10.3748/wjg.v24.i11.1269.
- Graf C., Welzel T., Bogdanou D., Vermehren J., Beckel A. et al. Hepatitis C Clearance by Direct-Acting Antivirals Impacts Glucose and Lipid Homeostasis. J. Clin. Med. 2020 Aug 21. 9(9). 2702. doi: 10.3390/jcm9092702.
- Rout G., Kedia S., Nayak B., Yadav R., Das P. et al. Controlled Attenuation Parameter for Assessment of Hepatic Steatosis in Indian Patients. J. Clin. Exp. Hepatol. 2019 Jan-Feb. 9(1). 13-21. doi: 10.1016/j.jceh.2018.02.010.
- Mauro E., Crespo G., Montironi C., Londoño M.C., Hernández-Gea V. et al. Portal pressure and liver stiffness measurements in the prediction of fibrosis regression after sustained virological response in recurrent hepatitis C. Hepatology. 2018 May. 67(5). 1683-1694. doi: 10.1002/hep.29557.
- Bassendine M.F., Nielsen S.U., Bridge S.H., Felmlee D.J., Sheridan D.A. et al. Hepatitis C virus and atherosclerosis: A legacy after virologic cure? Clin. Res. Hepatol. Gastroenterol. 2017 Feb. 41(1). 25-30. doi: 10.1016/j.clinre.2016.09.008.
- Batsaikhan B., Huang C.I., Yeh M.L., Huang C.F., Hou N.J. et al. The effect of antiviral therapy on serum lipid profiles in chro–nic hepatitis C. Oncotarget. 2018 Apr 20. 9(30). 21313-21321. doi: 10.18632/oncotarget.25092.
- Radwan M.I., Pasha H.F., Mohamed R.H., Hussien H.I., El-Khshab M.N. Influence of transforming growth factor-β1 and tumor necrosis factor-α genes polymorphisms on the development of cirrhosis and hepatocellular carcinoma in chronic hepatitis C patients. Cytokine. 2012 Oct. 60(1). 271-6. doi: 10.1016/j.cyto.2012.05.010.