Международный эндокринологический журнал Том 20, №2, 2024
Вернуться к номеру
Дефіцит йоду і неефективність його добавок у вагітних жінок у Польщі та його вплив на метаболізм щитоподібної залози
Авторы: Dorota Filipowicz (1), Ewelina Szczepanek-Parulska (1), Aniceta A. Mikulska-Sauermann (2), Marta Karazniewicz-Łada (2), Franciszek K. Gtowka (2), Krzysztof Szymanowski (3), Mariusz Ottarzewski (4), Lutz Schomburg (5), Marek Ruchata (1)
(1) - Department of Endocrinology, Metabolism and Internal Medicine, Poznan University of Medical Sciences, Poznan, Poland
(2) - Department of Physical Pharmacy and Pharmacokinetics, Poznan University of Medical Sciences, Poznan, Poland
(3) - Department of Perinatology and Gynaecology, Poznan University of Medical Sciences, Poznan, Poland
(4) - Institute of Mother and Child, Warsaw, Poland
(5) - Institute of Experimental Endocrinology, Charité — Universitätsmedizin Berlin, Berlin, Germany
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Йод є основним компонентом гормонів щитоподібної залози, і його дефіцит призводить до негативних наслідків вагітності. Тому під час вагітності рекомендується додатковий прийом йоду. Мета: шляхом оцінювання групи жінок із західної Польщі оновити дані щодо статусу йоду під час вагітності й ефективності добавок йоду щодо функції щитоподібної залози матері й новонародженого. Пацієнти та методи. У дослідження, яке проводилося між 2019 і 2021 роками, було включено 91 жінку перед пологами. Під час медичної співбесіди пацієнтки повідомили про споживання дієтичних добавок. Показники функції щитоподібної залози (ТТГ, ft3, ft4, a-TPO, a-Tg і TRAb) вимірювали в сироватці крові матерів і в пуповинній крові їх новонароджених немовлят. Концентрацію йоду в сечі (UIC) і співвідношення йод/креатинін (UIC/crea) оцінювали в окремих зразках сечі за допомогою валідованої високоефективної рідинної хроматографії з ультрафіолетовим детектуванням (HPLC-UV). Проведено аналіз неонатального скринінгу ТТГ із сухої плями крові. Результати. У вагітних жінок медіана (міжквартильний діапазон) UIC дорівнювала 106 (69–156) мкг/л і співвідношення UIC/crea становило 104 (62–221) мкг/г, тоді як приблизно 20 % мали UIC/crea нижче за 50 мкг/г, що вказує на наявність дефіциту йоду. Коефіцієнт споживання добавок йоду становив 68 %. Не було встановлено жодних вірогідних відмінностей щодо показників UIC, UIC/crea і параметрів щитоподібної залози між групами, які приймали добавки йоду і які їх не приймали, однак найвища йодурія була виявлена в разі призначення йоду на додаток до левотироксину порівняно з випадками, коли обидва ці препарати приймалися окремо. Пацієнтки з UIC/crea в межах 150–249 мкг/г продемонстрували найнижчі рівні ТТГ і а-ТРО. ТТГ був вище від 5 мМО/л у 6 % дітей. Висновки. Незважаючи на йодування солі, яке впроваджено на національному рівні, і рекомендації щодо додаткового вживання йоду під час вагітності, йодний статус і реальний рівень споживання йоду показали неефективність сучасної моделі профілактики йододефіциту під час вагітності.
Background. Iodine is a pivotal component of thyroid hormones, and its deficiency leads to negative pregnancy outcomes. Therefore, during gestation, additional iodine supplementation is recommended. By evaluating a group of women from western Poland, the study updated on iodine status during pregnancy and the effectiveness of iodine supplementation in relation to the maternal and neonatal thyroid function. Patients and methods. A total of 91 women were recruited before the delivery between 2019 and 2021. During the medical interview the patients declared their dietary supplements intake. Thyroid parameters (TSH, ft3, ft4, a-TPO, a-Tg, and TRAb) were measured in the serum of mothers and in the cord blood of newborns after birth. Urinary iodine concentration (UIC) and urine/creatinine (UlC/crea) ratio were assessed in single urine samples using a validated high- performance liquid chromatography with ultraviolet detection (HPLC-UV). Neonatal TSH screening from dried blood spot was analyzed. Results. Pregnant women showed a median (interquartile range) UIC of 106 (69–156) μg/liter and UIC/crea ratio of 104 (62–221) μg/g, whereas approximately 20 % had UIC/crea below 50 μg/g, indicating iodine deficiency. The iodine supplementation ratio was 68 %. No significant differences in UIC, UIC/crea and thyroid parameters were found between iodine supplemented and non-supplemented groups; however, the highest ioduria was detected when iodine was supplemented in addition to levothyroxine in comparison with both substances administered separately. Patients with UIC/crea within 150–249 μg/g demonstrated the lowest TSH and a-TPO levels. Screening TSH was above 5 mIU/liter in 6 % of children. Conclusions. Despite the national salt iodization and the recommendation to supplement iodine during gestation, the status of the abovementioned microelement and real-life intake revealed the ineffectiveness of the current iodine-deficiency prophylaxis model in pregnancy.
концентрація йоду в сечі (UIC); мікроелементи при вагітності; йод; селен; гіпотиреоз; тиреоїдит; пуповинна кров новонароджених; рекомендації щодо призначення добавок під час вагітності
urinary iodine concentration (UIC); micronutrients at pregnancy; iodine; selenium; hypothyroidism; thyroiditis; neonatal cord blood; pregnancy supplementation guidelines
Вступ
Пацієнти та методи
Статистичний аналіз
Результати
Обговорення
- Zimmermann MB. The importance of adequate iodine during pregnancy and infancy. World Rev Nutr Diet. 2016;115:118-24. doi: 10.1159/000442078.
- Puig-Domingo M, Vila L. The implications of iodine and its supplementation during pregnancy in fetal brain development. Curr Clin Pharmacol. 2013;8(2):97-109. doi: 10.2174/1574884711308020002.
- Chen X, Wu C, Wang Z, Wu C, Guo Y, Zhu X, et al. Iodine nutrition status and thyroid autoimmunity during pregnancy: a cross-sectional study of 4635 pregnant women. Nutr J. 2022;21(1):7. doi: 10.1186/s12937-022-00760-6.
- Pearce EN. Iodine deficiency in children. Endocr Dev. 2014;26:130-8. doi: 10.1159/000363160.
- Levie D, Korevaar TIM, Bath SC, Murcia M, Dineva M, Llop S, et al. Association of maternal iodine status with child IQ: a meta-analysis of individual participant data. J Clin Endocrinol Metab. 2019. 104(12):5957-67. doi: 10.1210/jc.2018-02559.
- Bath SC, Steer CD, Golding J, Emmett P, Rayman MP. Effect of inadequate iodine status in UK pregnant women on cognitive outcomes in their children: results from the Avon longitudinal study of parents and children (ALSPAC). Lancet Lond Engl. 2013;382(9889):331-7. doi: 10.1016/S0140-6736(13)60436-5.
- World Health Organization. Iodine deficiency in Europe: a continuing public health problem. World Health Organization. Switzerland: WHO Press; 2007. Available at: https://apps.who.int/iris/handle/10665/43398.
- Szybiński Z. Work of the polish council for control of iodine deficiency disorders, and the model of iodine prophylaxis in Poland. Endokrynol Pol. 2012;63(2):156-60.
- Szybinski Z, Delange F, Lewinski A, Podoba J, Rybakowa M, Wasik R, et al. A programme of iodine supplementation using only iodised household salt is efficient — the case of Poland. Eur J Endocrinol. 2001;144(4):331-7. doi: 10.1530/eje.0.1440331.
- Tykarski A, Narkiewicz K, Gaciong Z, Januszewicz A, Litwin M, Kostka-Jeziorny K, et al. 2015 Guidelines for the management of hypertension. Recommendations of the polish society of hypertension — short version. Kardiol Pol. 2015;73(8):676-700. doi: 10.5603/KP.2015.0157.
- Lewiński A, Zygmunt A. Iodine prophylaxis in Poland — new, old challenges. Ann Agric Environ Med. 2014;21(1):1-4.
- Gietka-Czernel M, Dębska M, Kretowicz P, Jastrzęb–ska H, Kondracka A, Snochowska H, et al. Iodine status of pregnant women from central Poland ten years after introduction of iodine prophylaxis programme. Endokrynol Pol. 2010;61(6):646-51.
- Trofimiuk-Müldner M, Konopka J, Sokołowski G, Dubiel A, Kieć-Klimczak M, Kluczyński Ł, et al. Current iodine nutrition status in Poland (2017): is the polish model of obligatory iodine prophylaxis able to eliminate iodine deficiency in the population? Public Health Nutr. 2020;23(14):2467-77. doi: 10.1017/S1368980020000403.
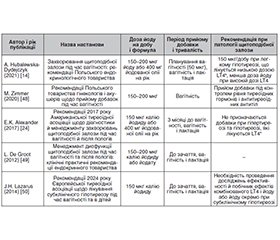
- Hubalewska-Dydejczyk A, Trofimiuk-Müldner M, Ruchala M, Lewiński A, Bednarczuk T, Zgliczyński W, et al. Thyroid diseases in pregnancy: guidelines of the polish society of endocrinology. Endokrynol Pol. 2021.72(5):425-88. doi: 10.5603/EP.a2021.0089.
- WHO Secretariat, Andersson M, de Benoist B, Delange F, Zupan J. Prevention and control of iodine deficiency in pregnant and lactating women and in children less than 2-years-old: conclusions and recommendations of the technical consultation. Public Health Nutr. 2007;10(12A):1606-11. doi: 10.1017/S1368980007361004.
- Milewicz T, Czyżewicz M, Stochmal E, Galicka-Latała D, Hubalewska-Dydejczyk A, Krzysiek J. Intake of iodine-containing multivitamin preparations by pregnant women from the Krakow region of Poland. Endokrynol Pol. 2011;62(4):309-15.
- Krasnodebska-Kiljańska M, Kondracka A, Bartoszewicz Z, Niedźwiedzka B, Ołtarzewski M, Grzesiuk W, et al. Iodine supply and thyroid function in the group of healthy pregnant women living in Warsaw. Pol Merkur Lek Organ Pol Tow Lek. 2013;34(202):200-4.
- Zygmunt A, Adamczewski Z, Zygmunt A, Adamczewska K, Trofimiuk-Muldner M, Hubalewska-Dydejczyk A, et al. An assessment of the effectiveness of iodine prophylaxis in pregnant women — analysis in one of reference gynaecologicalobstetric centres in Poland. Endokrynol Pol. 2015;66(5):404-11. doi: 10.5603/EP.2015.0050.
- Mikulska AA, Filipowicz D, Główka FK, Szczepanek-Parulska E, Ruchała M, Bartecki M, et al. HPLC analysis of the urinary iodine concentration in pregnant women. Molecules. 2021;26(22):6797. doi: 10.3390/molecules26226797.
- World Health Organization. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers, 3rd edn. Switzerland: WHO Press; 2007. Available at: https://apps.who.int/iris/handle/10665/43781.
- Sawicka-Gutaj N, Gruszczyński D, Guzik P, Mostowska A, Walkowiak J. Publication ethics of human studies in the light of the declaration of Helsinki — a mini-review. J Med Sci. 2022;91(2):e700. doi: 10.20883/medical.e700.
- Jastrzębska H, Kochman M, Bartoszewicz Z, Ołtarzewski M, Dębski R, Zgliczyńskiz W. Iodine supplementation during pregnancy of hypothyroid women treated with l-thyroxine neither influences neonatal TSH nor prevents decrease in maternal free thyroid hormone concentrations in second and third trimesters. Endokrynol Pol. 2016;67(4):367-74. doi: 10.5603/EP.a2016.0049.
- Zygmunt A, Lewinski A. Iodine prophylaxis in pregnant wo–men in Poland — where we are? (update 2015). Thyroid Res. 2015;8:17. doi: 10.1186/s13044-015-0029-z.
- Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017 Guidelines of the American thyroid association for the diagnosis and management of thyroid disease during pregnancy and the postpartum. Thyroid Off J Am Thyroid Assoc. 2017;27(3):315-89. doi: 10.1089/thy.2016.0457.
- Patel A, Lee SY, Stagnaro-Green A, MacKay D, Wong AW, Pearce EN. Iodine content of the best-selling united states adult and prenatal multivitamin preparations. Thyroid Off J Am Thyroid Assoc. 2019.29(1):124-7. doi: 10.1089/thy.2018.0386.
- Filipowicz D, Szczepanek-Parulska E, Kłobus M, Szymanowski K, Chillo TS, Asaad S, et al. Selenium status and supplementation effects in pregnancy-a study on mother-child pairs from a single-center cohort. Nutrients. 2022.14(15):3082. doi: 10.3390/nu14153082.
- Mikulska AA, Karaźniewicz-Łada M, Filipowicz D, Rucha–ła M, Główka FK. Metabolic characteristics of hashimoto’s thyroiditis patients and the role of microelements and diet in the disease management — an overview. Int J Mol Sci. 2022. 23(12):6580. doi: 10.3390/ijms23126580.
- Filipowicz D, Majewska K, Kalantarova A, Szczepanek-Parulska E, Ruchała M. The rationale for selenium supplementation in patients with autoimmune thyroiditis, according to the current state of knowledge. Endokrynol Pol. 2021.72(2):153-62. doi: 10.5603/EP.a2021.0017.
- Manousou S, Andersson M, Eggertsen R, Hunziker S, Hulthén L, Nyström HF. Iodine deficiency in pregnant women in Sweden: a national cross-sectional study. Eur J Nutr. 2020;59(6):2535-45. doi: 10.1007/s00394-019-02102-5.
- Andersson M, Hunziker S, Fingerhut R, Zimmerman MB, Herter-Aeberli I. Effectiveness of increased salt iodine concentration on iodine status: trend analysis of cross-sectional national studies in Switzerland. Eur J Nutr. 2020;59(2):581-93. doi: 10.1007/s00394-019-01927-4.
- Matta Coelho C, Guimarães J, Bracchi I, Xavier Moreira N, Pinheiro C, Ferreira P, et al. Noncompliance to iodine supplementation recommendation is a risk factor for iodine insufficiency in Portuguese pregnant women: results from the IoMum cohort. J Endocrinol Invest. 2022;45(10):1865-74. doi: 10.1007/s40618-022-01813-7.
- Pinheiro C, Xavier Moreira N, Ferreira P, Matta Coelho C, Guimarães J, Pereira G, et al. Iodine knowledge is associated with iodine status in Portuguese pregnant women: results from the IoMum cohort study. Br J Nutr. 2021;126(9):1331-9. doi: 10.1017/S0007114521000155.
- Li C, Peng S, Zhang X, Xie X, Wang D, Mao J, et al. The urine iodine to creatinine as an optimal index of iodine during pregnancy in an iodine adequate area in China. J Clin Endocrinol Metab. 2016;101(3):1290-8. doi: 10.1210/jc.2015-3519.
- Karbownik-Lewińska M, Stępniak J, Iwan P, Lewiński A. Iodine as a potential endocrine disruptor-a role of oxidative stress. Endocrine. 2022;78(2):219-40. doi: 10.1007/s12020-022-03107-7.
- Andrews KW, Roseland JM, Gusev PA, Palachuvattil J, Dang PT, Savarala S, et al. Analytical ingredient content and variability of adult multivitamin/mineral products: national estimates for the dietary supplement ingredient database. Am J Clin Nutr. 2017;105(2):526-39. doi: 10.3945/ajcn.116.134544.
- Wainwright P, Cook P. The assessment of iodine status — populations, individuals and limitations. Ann Clin Biochem. 2019;56(1):7-14. doi: 10.1177/0004563218774816.
- Cui L, Wen J, Zhou T, Wang S, Fan G. Optimization and validation of an ionpair RP-HPLC-UV method for the determination of total free iodine in rabbit plasma: application to a pharmacokinetic study. BioMed Chromatogr BMC. 2009;23(11):1151-9. doi: 10.1002/bmc.1237.
- Wang T, Liu Y, Kong Q, Cao X, Liu Y, Xia S, et al. Effect of moderate-to-Severe iodine deficiency in early pregnancy on subclinical hypothyroidism: a longitudinal study in an iodine-sufficient region in China. Front Nutr. 2022;9:839651. doi: 10.3389/fnut.2022.839651.
- Gowachirapant S, Jaiswal N, Melse-Boonstra A, Galetti V, Stincaa S, Mackenzie I, et al. Effect of iodine supplementation in pregnant women on child neurodevelopment: a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol. 2017;5(11):853-63. doi: 10.1016/S2213-8587(17)30332-7.
- Censi S, Watutantrige-Fernando S, Groccia G, Manso J, Plebani M, Faggian D, et al. The effects of iodine supplementation in pregnancy on iodine status, thyroglobulin levels and thyroid function parameters: results from a randomized controlled clinical trial in a mild-to-Moderate iodine deficiency area. Nutrients. 2019;11(11):E2639. doi: 10.3390/nu11112639.
- Dineva M, Fishpool H, Rayman MP, Mendis J, Bath SC. Systematic review and meta-analysis of the effects of iodine supplementation on thyroid function and child neurodevelopment in mildly-to-moderately iodine-deficient pregnant women. Am J Clin Nutr. 2020;112(2):389-412. doi: 10.1093/ajcn/nqaa071.
- Chen X, Chen L, Lian X, Liu X, Shan Z, Shi B, et al. Urinary iodine concentration is inversely associated with thyroglobulin antibo–dies. Endocr Pract. 2019;25(5):454-60. doi: 10.4158/EP-2018-0252.
- van Heek L, Staudacher C, Faust M, Chiapponi C, Mettler J, Schmidt M, et al. Avoidance of iodine deficiency/excess during pregnancy in hashimoto’s thyroiditis. Nukl Nucl Med. 2021;60(4):266-71. doi: 10.1055/a-1400-3522.
- Delshad H, Raeisi A, Abdollahi Z, Tohidi M, Hedayati M, Mirmiran P, et al. Iodine supplementation for pregnant women: a cross-sectional national interventional study. J Endocrinol Invest. 2021;44(10):2307-14. doi: 10.1007/s40618-021-01538-z.
- Zimmermann MB, Aeberli I, Torresani T, Bürgi H. Increasing the iodine concentration in the Swiss iodized salt program markedly improved iodine status in pregnant women and children: a 5-y prospective national study. Am J Clin Nutr. 2005;82(2):388-92. doi: 10.1093/ajcn.82.2.388.
- Cuestas E, Gaido MI, Capra RH. Transient neonatal hyperthyrotropinemia is a risk factor for developing persistent hyperthyrotropinemia in childhood with repercussion on developmental status. Eur J Endocrinol. 2015;172(4):483-90. doi: 10.1530/EJE-13-0907.
- Sullivan KM. Iodine supplementation for pregnancy and lactation: united states and Canada: recommendations of the American thyroid association. Thyroid Off J Am Thyroid Assoc. 2007;17(5):483-4. doi: 10.1089/thy.2007.0073.
- Zimmer M, Sieroszewski P, Oszukowski P, Huras H, Fuchs T, Pawlosek A, et al. Polish society of gynecologists and obstetricians recommendations on supplementation during pregnancy. Ginekol Pol. 2020;91(10):644-53. doi: 10.5603/GP.2020.0159.
- De Groot L, Abalovich M, Alexander EK, Amino N, Barbou L, Cobin RH, et al. Management of thyroid dysfunction during pregnancy and postpartum: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2012;97(8):2543-65. doi: 10.1210/jc.2011-2803.
- Lazarus J, Brown RS, Daumerie C, Hubalewska-Dydej–czyk A, Negro R, Vaidya B, et al. 2014 European Thyroid association guidelines for the management of subclinical hypothyroidism in pregnancy and in children. Eur Thyroid J. 2014;3(2):76-94. doi: 10.1159/000362597.

/21.jpg)
/22.jpg)
/22_2.jpg)
/23.jpg)
/24.jpg)
/25.jpg)