Журнал «Здоровье ребенка» Том 20, №7, 2025
Вернуться к номеру
Прогнозування наслідків післяасфіктичних ушкоджень мозку у немовлят на тлі лікувальної гіпотермії
Авторы: Мавропуло Т.К., Соломенко М.В.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
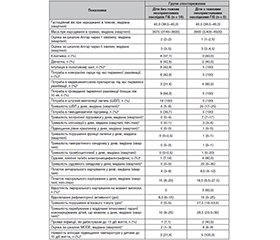
Актуальність. Асфіксія при народженні є третьою найпоширенішою причиною смерті новонароджених (23 %). Майже з такою ж частотою розвиваються тяжкі неврологічні порушення. Лікувальна гіпотермія (ЛГ) є ефективною та безпечною стратегією у доношених дітей, знижує ризик поєднаного результату смерті і/або значної інвалідності у віці 18 місяців. Однак у понад 40 % немовлят з гіпоксично-ішемічною енцефалопатією (ГІЕ) середнього та тяжкого ступеня розвиваються довгострокові несприятливі наслідки. Сучасні наукові дослідження насамперед присвячені питанням визначення прогнозу ураження мозку при проведенні лікувальної гіпотермії. Для прогнозування наслідків гіпоксично-ішемічної енцефалопатії використовують комбінації показників, наприклад комбіновану шкалу мультиорганної дисфункції (MODE Score). Також зберігається орієнтація на окремі показники, але спектр їх постійно розширюється. Оцінка терморегуляції відображає тяжкість ушкодження мозку і є перспективним прогностичним маркером. Вищу температуру дитини під час проведення ЛГ пов’язують з несприятливими наслідками для нейророзвитку у 18-місячному віці. Метою нашого дослідження була перевірка гіпотези про те, що немовлята з тяжкими несприятливими наслідками гіпоксично-ішемічної енцефалопатії демонструють порушення терморегуляції (коливання аксилярної температури після закінчення ЛГ) до 10-денного віку. Матеріали та методи. Робота виконана на базі неонатального центру та центру катамнестичного спостереження КП «Регіональний медичний центр родинного здоров’я» Дніпровської обласної ради. Дизайн дослідження був визначений як ретроспективне одноцентрове клінічне дослідження. У дослідження були включені 19 дітей, які досягли другого року життя і яким проводилась ЛГ у післяасфіктичному періоді протягом 2023–2024 років (використовувалась системна гіпотермія з апаратними засобами охолодження). Інформація щодо неонатального періоду була отримана на підставі аналізу медичної документації. Оцінка ступеня постасфіктичної поліорганної дисфункції проводилася за шкалою MODE, яка включала характеристику стану неврологічної, серцево-судинної, дихальної, шлунково-кишкової, ниркової системи, гематологічні показники, оцінку нейровізуалізації та електроенцефалографії. Моніторинг температури під час проведення ЛГ здійснювався за допомогою ректального датчика, після закінчення ЛГ до 10-ї доби життя проводився контроль аксилярної температури (вимірювання кожні 2 години). Результати. Серед обстежених 19 дітей (10 хлопчиків та 9 дівчаток) тяжкі несприятливі наслідки гіпоксично-ішемічної енцефалопатії мали 5 (26,3 %) дітей. Діти з тяжкими несприятливими наслідками гіпоксично-ішемічної енцефалопатії вірогідно (p < 0,05) відрізнялись від групи без тяжких наслідків за частотою заходів розширеної первинної реанімації (потреба в медикаментозних препаратах під час первинної реанімації — 80,0 проти 21,4 %), проявами поліорганної дисфункції, відображенням якої є оцінка за шкалою MODE (8 (6–9) балів проти 2 (1–3)), а також наявністю проявів температурної нестабільності після періоду ЛГ (наявність епізодів підвищення аксилярної температури у дитини до 10 діб життя — 100,0 проти 21,4 %). Наявність епізодів підвищення температури у дитини до 10 діб життя мала вірогідні (р < 0,05) кореляції з такими параметрами, як потреба у розширеній первинній реанімації (rs = 0,671); ступінь постасфіктичної поліорганної дисфункції за шкалою MODE (rs = 0,673); наявність судом (rs = 0,610), патологічних змін м’язового тонусу (rs = 0,585) чи відсутність перорального харчування (rs = 0,507) на момент виписки; наявність деструктивних змін мозкової тканини (rs = 0,701). Прояви інфекції, які дебютували до 10 діб життя, реєстрували у 1 (7,1 %) дитини в групі без несприятливих наслідків і у 2 (40,0 %) дітей з групи з несприятливими наслідками (р = 0,155). Прояви температурної дизрегуляції передбачали тяжкі довгострокові наслідки (аналіз ROC-кривої) з доброю діагностичною точністю (AUC = 0,893) на відміну від шкали MODE, яка демонструвала відмінну діагностичну точність (AUC = 0,993). Обидва показники мали 100% чутливість при своїх оптимальних порогах, але специфічність для прогнозування у шкали MODE була кращою (0,786 проти 0,929). Висновки. Ми отримали результати, які підтверджують гіпотезу, що немовлята з тяжкими несприятливими наслідками ГІЕ після проведення ЛГ демонструватимуть порушення терморегуляції (підвищення температури при продовженні моніторингу шкірної температури після закінчення ЛГ) до 10-денного віку. Обидва показники оцінки (шкала MODE і прояви температурної дизрегуляції) мали 100% чутливість щодо прогнозування тяжких несприятливих наслідків ГІЕ, але специфічність для прогнозування у шкали MODE була кращою. Необхідні подальші дослідження, щоб довести, чи пов’язані епізоди зміни температури після ЛГ з несприятливими наслідками ГІЕ.
Background. Birth asphyxia remains the third leading cause of neonatal mortality (23 %) and is associated with a nearly equivalent incidence of severe neurological impairment. Therapeutic hypothermia (TH) is an effective and safe treatment strategy for term infants, reducing the combined risk of death or major disability at 18 months of age. However, more than 40 % of infants with moderate-to-severe hypoxic-ischemic encephalopathy (HIE) still develop long-term adverse outcomes. Modern scientific publications are primarily focused on the issues of predicting brain damage in the context of therapeutic hypothermia. Predicting the outcomes of HIE at the present stage is based on combinations of clinical and laboratory parameters, such as the combined Multiorgan Dysfunction Evaluation (MODE) score. Nonetheless, individual indicators remain important, and their spectrum continues to expand. Thermoregulation assessment has emerged as a promising marker for outcome prediction, as it reflects the extent of brain injury. Higher body temperature in infants during TH has been associated with adverse neurodevelopmental outcomes at 18 months of age. Therefore, the purpose of our study was to test the hypothesis that infants with severe adverse outcomes of HIE exhibit impaired thermoregulation — manifested by fluctuations in axillary temperature after the completion of TH — within the first 10 days of life. Materials and methods. The study was conducted at the Neonatal Center and the Follow-up Observation Center of the Regional Medical Center for Family Health at the Dnipro Regional Council. The research design was defined as a retrospective, single-center clinical study. The study cohort included 19 children who had received device-controlled systemic TH as part of their neonatal management for post-asphyxial encephalopathy during 2023–2024 and had reached two years of age. Data concerning the neonatal period were obtained through the analysis of medical records. The degree of post-asphyxial multiorgan dysfunction was assessed using the MODE score, which encompassed evaluation of the neurological, cardiovascular, respiratory, gastrointestinal, and renal systems, as well as hematologic parameters, neuroimaging findings, and electroencephalographic characteristics. During TH, body temperature was monitored continuously via a rectal sensor; after hypothermia, axillary temperature was assessed up to the 10th day of life, with measurements performed every two hours. Results. Among the 19 infants examined (10 males and 9 females), 5 children (26.3 %) demonstrated severe adverse outcomes of HIE. They significantly differed (p < 0.05) from those without such outcomes in several key parameters. The frequency of advanced resuscitation measures, specifically the need for pharmacologic interventions during initial resuscitation, was markedly higher (80.0 vs. 21.4 %). These infants also exhibited more pronounced multiorgan dysfunction, as reflected by higher MODE scores: 8 (6–9) vs. 2 (1–3), and showed a greater incidence of temperature instability following TH, with episodes of axillary temperature elevation within the first 10 days of life observed in all affected infants (100.0 vs. 21.4 %). The occurrence of temperature elevation episodes during the first 10 days of life demonstrated significant correlations (p < 0.05) with several clinical parameters such as the need for advanced resuscitation (rs = 0.671), the degree of post-asphyxial multiorgan dysfunction according to the MODE score (rs = 0.673), presence of seizures (rs = 0.610), pathological muscle tone abnormalities (rs = 0.585) or absence of oral feeding at discharge (rs = 0.507), and destructive changes in brain tissue on neuroimaging (rs = 0.701). Signs of infection emerging within the first 10 days of life were identified in 1 infant (7.1 %) in the group without adverse outcomes and in 2 infants (40.0 %) in the group with adverse outcomes (p = 0.155). Thermoregulatory disorders predicted severe long-term outcomes with good diagnostic accuracy according to the ROC curve analysis (AUC = 0.893), whereas the MODE score demonstrated excellent diagnostic accuracy (AUC = 0.993). Both indicators achieved 100 % sensitivity at their optimal thresholds; however, specificity was higher for the MODE score (0.929 vs. 0.786). Conclusions. Our findings support the hypothesis that infants with severe adverse outcomes of HIE following TH exhibit impaired thermoregulation — manifested as elevated skin temperature during continued post-hypothermia temperature monitoring — within the first 10 days of life. Both evaluated parameters, the MODE score and manifestations of thermoregulatory disorders, demonstrated 100 % sensitivity for predicting severe adverse outcomes of HIE. However, the MODE score showed superior specificity for prognostic purposes. Further studies are needed to investigate whether episodes of temperature change after TH are associated with adverse outcomes of HIE.
асфіксія; лікувальна гіпотермія; гіпоксично-ішемічна енцефалопатія; поліорганна дисфункція; наслідки; температура тіла; новонароджені; немовлята
asphyxia; therapeutic hypothermia; hypoxic-ischemic encephalopathy; multiorgan dysfunction; outcomes; body temperature; neonates; infants
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Sutin J, Vyas R, Feldman HA, Ferradal S, Hsiao CH, Zampolli L, et al. Association of cerebral metabolic rate following therapeutic hypothermia with 18-month neurodevelopmental outcomes after neonatal hypoxic ischemic encephalopathy. EBioMedicine. 2023 Aug;94:104673. doi: 10.1016/j.ebiom.2023.104673. Epub 2023 Jun 29. PMID: 37392599; PMCID: PMC10338207.
- Hawkins CC, Spiegel E, Allen DD, Nesbit K. The impact of therapeutic hypothermia on developmental outcomes in lower-middle income countries: A systematic review and meta-analysis with a health equity lens. Pediatr Neonatol. 2025 Apr 19:S1875-9572(25)00083-X. doi: 10.1016/j.pedneo.2024.09.010. Epub ahead of print. PMID: 40287349.
- Marques KL, Rodrigues V, Balduci CTN, Montes GC, Barradas PC, Cunha-Rodrigues MC. Emerging therapeutic strategies in hypoxic-ischemic encephalopathy: a focus on cognitive outcomes. Front Pharmacol. 2024 Feb 26;15:1347529. doi: 10.3389/fphar.2024.1347529. PMID: 38469401; PMCID: PMC10925695.
- Ovcjak A, Pontello R, Miller SP, Sun HS, Feng ZP. Hypothermia combined with neuroprotective adjuvants shortens the duration of hospitalization in infants with hypoxic ischemic encephalopathy: Meta-analysis. Front Pharmacol. 2023 Jan 6;13:1037131. doi: 10.3389/fphar.2022.1037131. PMID: 36686686; PMCID: PMC9853207.
- Zhou T, Liang P, Dai N, Ma M, Lin J, Zhu J, Ren G. Therapeutic hypothermia for neonates: a bibliometric analysis and visualization research. Front Neurol. 2025 May 7;16:1565749. doi: 10.3389/fneur.2025.1565749. PMID: 40401026; PMCID: PMC12092385.
- Aoki Y, Kono T, Enokizono M, Okazaki K. Short-term outcomes in infants with mild neonatal encephalopathy: a retrospective, observatio–nal study. BMC Pediatr. 2021 May 7;21(1):224. doi: 10.1186/s12887-021-02688-y. PMID: 33962618; PMCID: PMC8103637.
- Murray DM, Bala P, O’Connor CM, Ryan CA, Connolly S, Boylan GB. The predictive value of early neurological examination in neonatal hypoxic-ischaemic encephalopathy and neurodevelopmental outcome at 24 months. Dev Med Child Neurol. 2010 Feb;52(2):e55-9. doi: 10.1111/j.1469-8749.2009.03550.x. Epub 2009 Dec 23. PMID: 20041933.
- Gubler DFL, Wenger A, Boos V, Liamlahi R, Hagmann C, Brotschi B, Grass B. Redirection of Care for Neonates with Hypoxic-Ischemic Encephalopathy Receiving Therapeutic Hypothermia. J Clin Med. 2025 Jan 7;14(2):317. doi: 10.3390/jcm14020317. PMID: 39860326; PMCID: PMC11765625.
- Shankaran S, Laptook AR, Tyson JE, Ehrenkranz RA, Bann CM, Das A, et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Evolution of encephalopathy during whole body hypothermia for neonatal hypoxic-ischemic encephalopathy. J Pediatr. 2012 Apr;160(4):567-572.e3. doi: 10.1016/j.jpeds.2011.09.018. Epub 2011 Nov 1. PMID: 22050871; –PMCID: PMC3299861.
- Mietzsch U, Kolnik SE, Wood TR, Natarajan N, Gonzalez FF, Glass H, et al.; HEAL Trial Study Group. Evolution of the Sarnat exam and association with 2-year outcomes in infants with moderate or severe hypoxic-ischaemic encephalopathy: a secondary analysis of the HEAL Trial. Arch Dis Child Fetal Neonatal Ed. 2024 Apr 18;109(3):308-316. doi: 10.1136/archdischild-2023-326102. PMID: 38071538; PMCID: PMC11031347.
- DuPont TL, Chalak LF, Morriss MC, Burchfield PJ, Christie L, Sánchez PJ. Short-term outcomes of newborns with perinatal acidemia who are not eligible for systemic hypothermia therapy. J Pediatr. 2013 Jan;162(1):35-41. doi: 10.1016/j.jpeds.2012.06.042. Epub 2012 Aug 4. PMID: 22871488; PMCID: PMC3712522.
- Debillon T, Bednarek N, Ego A; LyTONEPAL Writing Group. LyTONEPAL: long term outcome of neonatal hypoxic encephalopathy in the era of neuroprotective treatment with hypothermia: a French population-based cohort. BMC Pediatr. 2018 Aug 1;18(1):255. doi: 10.1186/s12887-018-1232-6. PMID: 30068301; PMCID: PMC6090887.
- Bonifacio SL, Chalak LF, Van Meurs KP, Laptook AR, Shankaran S. Neuroprotection for hypoxic-ischemic encephalopathy: Contributions from the neonatal research network. Semin Perinatol. 2022 Nov;46(7):151639. doi: 10.1016/j.semperi.2022.151639. Epub 2022 Jun 10. PMID: 35835616; PMCID: PMC11500562.
- El Shahed AI, Branson HM, Chacko A, Terumalay S, Zheng X, Pang EW, et al. Predictive model of neurodevelopmental outcome in neonatal hypoxic ischemic encephalopathy. Early Hum Dev. 2025 Feb;201:106189. doi: 10.1016/j.earlhumdev.2024.106189. Epub 2025 Jan 2. PMID: 39787883.
- Bonifacio SL, Hutson S. The Term Newborn: Evaluation for Hypoxic-Ischemic Encephalopathy. Clin Perinatol. 2021 Aug;48(3):681-695. doi: 10.1016/j.clp.2021.05.014. PMID: 34353587.
- Тroha Gergeli A, Škofljanec A, Neubauer D, Paro Panjan D, Kodrič J, Osredkar D. Prognostic Value of Various Diagnostic Methods for Long-Term Outcome of Newborns After Hypoxic-Ischemic Encephalopathy Treated With Hypothermia. Front Pediatr. 2022 Apr 7;10:856615. doi: 10.3389/fped.2022.856615. Erratum in: Front Pediatr. 2023 Jun 22;11:1226835. doi: 10.3389/fped.2023.1226835. PMID: 35463898; PMCID: PMC9021608.
- Sweetman DU, Strickland T, Isweisi E, Kelly L, Slevin MT, Donoghue V, et al. Multi-organ dysfunction scoring in neonatal encephalopathy (MODE Score) and neurodevelopmental outcomes. Acta Paediatr. 2022 Jan;111(1):93-98. doi: 10.1111/apa.16111. Epub 2021 Sep 22. PMID: 34528287.
- Enweronu-Laryea C, Martinello KA, Rose M, Manu S, Tann CJ, Meek J, et al. Core temperature after birth in babies with neonatal encephalopathy in a sub-Saharan African hospital setting. J Physiol. 2019 Aug;597(15):4013-4024. doi: 10.1113/JP277820. Epub 2019 Jun 5. PMID: 31168907; PMCID: PMC6767688.
- Mietzsch U, Flibotte JJ, Law JB, Puia-Dumitrescu M, Juul SE, Wood TR. Temperature dysregulation during therapeutic hypothermia predicts long-term outcome in neonates with HIE. J Cereb Blood Flow Metab. 2023 Jul;43(7):1180-1193. doi: 10.1177/0271678X231162174. Epub 2023 Mar 8. PMID: 36883364; PMCID: PMC10291460.
- Tsuda K, Shibasaki J, Isayama T, Takeuchi A, Mukai T, Ioroi T, et al.; Baby Cooling Registry of Japan. Body temperature, heart rate and long-term outcome of cooled infants: an observational study. Pediatr Res. 2022 Mar;91(4):921-928. doi: 10.1038/s41390-021-01502-w. Epub 2021 Apr 12. PMID: 33846554.
- Lee-Kelland R, Chakkarapani E, Jarry S, Liu X, Smolicz I, Scull-Brown E, Thoresen M. Overcooling During Therapeutic Hypothermia and Temperature Instability after Rewarming are associated with a Poorer Neurodevelopmental Outcome. Presented at the Neonatal Society 2015 Spring. March 19, 2015. https://www.neonatalsociety.ac.uk/2015/03/19/overcooling-during-therapeutic-hypothermia-and-temperature-instability-after-rewarming-are-associated-with-a-poorer-neurodevelopmental-outcome/.
- World Health Organization. http://www.childmortality.org/. Global Health Observatory (GHO); WHO 2016. Accessed April 10, 2020.
- Walas W, Wilińska M, Bekiesińska-Figatowska M, Halaba Z, Śmigiel R. Methods for assessing the severity of perinatal asphyxia and early prognostic tools in neonates with hypoxic-ischemic encephalopathy treated with therapeutic hypothermia. Adv Clin Exp Med. 2020 Aug;29(8):1011-1016. doi: 10.17219/acem/124437. PMID: 32820870.
- Natarajan G, Laptook A, Shankaran S. Therapeutic Hypothermia: How Can We Optimize This Therapy to Further Improve Outcomes? Clin Perinatol. 2018 Jun;45(2):241-255. doi: 10.1016/j.clp.2018.01.010. Epub 2018 Feb 23. PMID: 29747886; PMCID: PMC5953210.
- Соколова К.Ю. Час початку лікувальної гіпотермії та перебіг гіпоксично-ішемічної енцефалопатії у доношених новонароджених. Здоров’я дитини. 2020;15(1):36-41. http://nbuv.gov.ua/UJRN/Zd_2020_15_1_9.
- Руідігер М., Бабінцева A., Годованець Ю. Лікувальна гіпотермія новонароджених: рекомендації Universitätsklinikum Carl Gustav Carus (м. Дрезден, Німеччина). Неонатологія, хірургія та перинатальна медицина. 2023;13(1(47):53-59. https://doi.org/10.24061/2413-4260.XIII.1.47.2023.8.
- Laptook AR, McDonald SA, Shankaran S, et al. Elevated temperature and 6- to 7-year outcome of neonatal encephalopathy. Ann Neurol. 2013;73(4):520–8. doi: 10.1002/ana.23843.
- Owji ZP, Gilbert G, Saint-Martin C, Wintermark P. Brain Temperature Is Increased During the First Days of Life in Asphyxiated Newborns: Developing Brain Injury Despite Hypothermia Treatment. AJNR Am J Neuroradiol. 2017 Nov;38(11):2180-2186. doi: 10.3174/ajnr.A5350. Epub 2017 Aug 31. PMID: 28860214; PMCID: PMC7963566.