Международный эндокринологический журнал 3 (67) 2015
Вернуться к номеру
Діагностичні маркери та спосіб прогнозування розвитку хронічного панкреатиту при цукровому діабеті 2-го типу
Авторы: Журавльова Л.В., Шеховцова Ю.О. — Харківський національний медичний університет; Арсеньєв О.В. — Національний фармацевтичний університет, м. Харків
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета роботи — визначення діагностичних маркерів та способу прогнозування хронічного панкреатиту у хворих на цукровий діабет 2-го типу. Матеріали та методи. Обстежено 94 пацієнти з цукровим діабетом 2-го типу (33 чоловіки та 61 жінка) середнім віком 58,94 ± 1,02 року, з яких 32 пацієнти з ізольованим цукровим діабетом 2-го типу становили першу групу, а 62 пацієнти, яким був встановлений діагноз хронічного панкреатиту, — другу групу. Результати. Встановлено вірогідне підвищення плазмових рівнів апеліну та фактору некрозу пухлини альфа, а також погіршення показників вуглеводного, ліпідного обміну та функціонального стану підшлункової залози у хворих із поєднаним перебігом хронічного панкреатиту та цукрового діабету 2-го типу. Встановлений зв’язок між рівнями апеліну, фактора некрозу пухлини альфа та показниками вуглеводного, ліпідного обміну та функціонального стану підшлункової залози у хворих із коморбідною патологією. Був розроблений спосіб прогнозування хронічного панкреатиту у хворих на цукровий діабет 2-го типу. Висновки. В результаті проведеного дослідження були виявлені основні діагностичні маркери хронічного панкреатиту у хворих на цукровий діабет 2-го типу, до яких належать С-реактивний протеїн, α-амілаза, апелін та еластаза-1.
Цель работы — определение диагностических маркеров и способа прогнозирования хронического панкреатита у больных сахарным диабетом 2-го типа. Материалы и методы. Обследованы 94 пациента, страдающих сахарным диабетом 2-го типа (33 мужчины и 61 женщина), средний возраст которых составил 58,94 ± 1,02 года, из них 32 пациента с изолированным сахарным диабетом 2-го типа составили первую группу, а 62 пациента, которым был поставлен диагноз хронического панкреатита, — вторую группу. Результаты. Выявлено достоверное повышение плазменных уровней апелина и фактора некроза опухоли альфа, а также ухудшение показателей углеводного, липидного обмена и функционального состояния поджелудочной железы у больных с сочетанным течением хронического панкреатита и сахарного диабета 2-го типа. Установлена связь между уровнями апелина, фактора некроза опухоли альфа и показателями углеводного, липидного обмена и функционального состояния поджелудочной железы у больных с коморбидной патологией. Выводы. В результате проведенного исследования были выявлены основные диагностические маркеры хронического панкреатита у больных сахарным диабетом 2-го типа, к которым относятся С-реактивный протеин, α-амилаза, апелин и эластаза-1, и был разработан способ прогнозирования хронического панкреатита у больных сахарным диабетом 2-го типа.
The purpose of the present study was to determine the diagnostic markers and the method of predicting of chronic pancreatitis in type 2 diabetes mellitus patients. Materials and methods. A total of 94 patients (33 males and 61 females, mean aged 58.94 ± 1.02) with type 2 diabetes mellitus were examined. The patients were divided into 2 groups: 1st group (n = 32) includes patients with isolated type 2 diabetes mellitus, 2nd group (n = 62)
consisted of combined course of type 2 diabetes mellitus and chronic pancreatitis. Results. It was found significantly increased levels of apelin and tumor necrosis factor alpha, and worsening of indicators of carbohydrate, lipid metabolism and functional state of the pancreas in combined course of chronic pancreatitis and type 2 diabetes mellitus. It was found correlations between levels of apelin, tumor necrosis factor alpha, indicators of carbohydrate, lipid metabolism and functional state of the pancreas in patients with combined pathology. Conclusions. As the result of the study there were determined basic diagnostic markers of chronic pancreatitis at type 2 diabetes mellitus: C-reactive protein, α-amilase, apelin and elastase-1. It was found the method of chronic pancreatitis prognosis in patients with type 2 diabetes mellitus.
цукровий діабет 2-го типу, хронічний панкреатит, діагностичні маркери, прогнозування.
сахарный диабет 2-го типа, хронический панкреатит, диагностические маркеры, прогнозирование.
type 2 diabetes mellitus, chronic pancreatitis, diagnostic markers, prognosis.
Статья опубликована на с. 24-29
Вступ
Цукровий діабет (ЦД) — одне з найпоширеніших захворювань у всьому світі, в структурі якого переважає ЦД 2-го типу (ЦД2). Кількість таких хворих перевищує 350 млн осіб, а щорічний приріст становить 5–7 % [2].
За даними епідеміологічних досліджень, у 28–36 % хворих на ЦД2 діагностується хронічний панкреатит (ХП) [19]. Основні ланки патогенезу ЦД2 мають дуже тісні зв’язки з функціональним станом підшлункової залози (ПЗ). До них належать: оксидативний стрес, ендотеліальна дисфункція, зміни ліпідного та цитокінового спектра крові, дисбаланс між ендотеліальним фактором релаксації NO та вазоконстрикторними факторами, коагуляцією та фібринолізом [2].
Сучасним еталонним методом ранньої діагностики зовнішньосекреторної недостатності ПЗ (ЗНПЗ) та визначення її ступеня є інвазивний секретин-панкреазиміновий тест. Однак необхідність дуоденального зондування, гормональної стимуляції ПЗ, а також аспірація й аналіз панкреатичних ферментів, що виділяються, потребують фінансових, трудових витрат, а також часу. Дослідження досить складне для пацієнта та при багатьох післяопераційних станах стає неможливим. Тому секретин-панкреазиміновий тест здійснюється рідко навіть у спеціалізованих центрах. Точність тесту може знижуватись через неправильне положення зонду, неповну аспірацію панкреатичного секрету з дванадцятипалої кишки. Це лише частково компенсується допоміжними вимірюваннями дебіту маркерів. Секретиновий тест дозволяє виміряти об’єм стимульованої секреції, однак надмірна стимуляція ПЗ не є фізіологічною. Цей тест дозволяє оцінити тільки активність інтрадуоденальних ферментів. Окрім того, він не використовується для контролю замісної ферментної терапії.
Останнім часом більш реальною альтернативою секретиновому тесту є ендоскопічне дослідження функції ПЗ [13]. У проспективному перехресному дослідженні цей метод порівнювався із зондовою аспірацією інтрадуоденального секрету після стимуляції секретином [17]. Ендоскопія з аспірацією дуоденального вмісту протягом 60 хвилин, незважаючи на використання ультратонкого гастроскопу (6 мм), складна як для пацієнта, так і для лікаря-ендоскопіста. Окрім того, шлунковий уміст може бути аспірований тільки перед початком дуоденального зондування, а протягом дослідження шлунковий секрет може змішуватися з дуоденальним.
Деякі автори вивчали можливість використання магнітно-резонансної холангіопанкреатографії (МРХПГ) для оцінки функціонального стану ПЗ; цей метод відображує незначні морфологічні зміни після гормональної стимуляції. Для оцінки функції ПЗ при МРХПГ передбачається оцінювати ступінь наповнення дванадцятипалої кишки і діаметр головної панкреатичної протоки після секретинової стимуляції [10, 15, 16]. Нещодавно була розроблена методика секретин-стимульованої дифузно-зваженої магнітно-резонансної томографії, що дозволяє оцінити функціональний стан ПЗ шляхом визначення змін об’єму рідини в паренхімі ПЗ [11]. Коефіцієнт дифузії дозволяє судити щодо швидкості дифузії рідини та зростає після ін’єкції секретину. Вважається, що ця методика більш чутлива, ніж традиційна секретин-стимульована МРХПГ. Однак нова методика МРХПГ потребує подальших досліджень, порівняння зі стандартним критерієм — секретиновим тестом з аспірацією секрету ПЗ.
На відміну від усіх інших досліджень функціонального стану ПЗ 13С-дихальні тести з 13С-міченими тригліцеридами, холестероловими ефірами, білками та вуглеводнями як субстрати є неінвазивними, відображають інтрадуоденальну активність панкреатичних ферментів у фізіологічних умовах, а також повний процес гідролізу субстрату від уведення в шлунок і виходу в дванадцятипалу кишку ферментного перетравлення, абсорбції та окислення субстрату до кінцевого продукту метаболізму. Використання ізотопного індикатора не впливає на процес травлення та краще відтворює фізіологічні умови. Окрім того, використання нерадіоактивних субстратів дозволяє проводити ці дослідження у дітей, підлітків та вагітних.
У клінічній практиці більш широко використовуються такі неінвазивні непрямі тести, як бентирамідний тест, панкреолауриловий тест, вимірювання екскреції жиру з калом. Однак вони менш чутливі, ніж секретиновий тест, і їх результати залежать від правильності збору сечі та калу пацієнтом. Так, аналіз 72-годинної екскреції жиру з калом не популярний і серед пацієнтів, і серед медперсоналу, а, крім того, результат може бути спотворено при неправильному (неповному) зборі калу.
Визначення фекальної еластази-1 — відносно недорогого маркера екзокринної функції ПЗ — широко використовується і останніми роками часто замінює інші непрямі тести. Однак кількість фекальної еластази-1 значно змінюється у пацієнтів із діареєю. Зменшення кількості рідини в калі значно збільшує можливість правильної оцінки цього маркера.
Є дані, що при ЦД2 спочатку уражується переважно ендокринна функція ПЗ, а вже згодом і екзокринна функція [19]. Багато досліджень були присвячені проблемі ЗНПЗ у хворих на ЦД2 [18, 19]. За результатами цих досліджень, ЗНПЗ виявлялась на підставі визначення рівня фекальної панкреатичної еластази-1 і траплялася у 28–36 % випадків, тобто в середньому у 32 % всіх досліджуваних хворих на ЦД2.
Сучасні візуалізуючі методики, що включають ультразвукове дослідження (УЗД), комп’ютерну томографію та магнітно–резонансну томографію, дають можливість виявити зміни в ПЗ, але не дозволяють надійно діагностувати ХП або стеатоз ПЗ. До ультразвукових ознак ХП слід зараховувати збільшення розмірів ПЗ загалом або її частини, зміни ехогенності ПЗ, нечіткість та нерівність контурів, неоднорідність структури ПЗ, наявність кальцифікатів, псевдокист та розширення вірсунгового та/або бокових проток ПЗ. Однак ці характеристики не є специфічними і вимагають інтерпретації з огляду на клінічні і анамнестичні дані.
Сьогодні діагноз ХП, особливо на тлі ЦД2, може бути встановлений тільки на пізніх стадіях, коли виявляються і патологічні зміни проток, порушення функції ПЗ, тобто захворювання є необоротним. Труднощі діагностики, особливо на ранніх стадіях ХП та при супутньому ЦД2, пов’язані з відсутністю можливості клініцистів отримати тканину або гістологічний зразок для підтвердження діагнозу. Розвиток ендоскопічної ультразвукової біопсії відкрив можливості аналізу панкреатичної тканини, однак гістологічний діагноз ХП залишається далеким від того, щоб стати рутинною процедурою. Тому діагноз у клінічній практиці ґрунтується на виявленні за допомогою методів візуалізації морфологічних та функціональних змін, що розвиваються з плином часу.
У процесі узагальнення існуючих даних про діагностику ХП, зокрема ранню, можна дійти висновку, що є необхідність у дослідженні нових маркерів даної патології, таких як гормони жирової тканини, а саме — апелін, інтерлейкін-1 (ІЛ-1), фактор некрозу пухлини альфа (ФНП-aльфа). Їх діагностична роль потребує ретельного вивчення та дослідження.
Значення проблеми коморбідності ЦД2 та ХП полягає у додаткових труднощах для встановлення діагнозу та проведення адекватної терапії, зважаючи на тісні відношення етіопатогенетичних ланок цих станів, що призводить до погіршення якості життя пацієнтів, збільшення витрат на діагностику та лікування, збільшення частоти та тривалості перебування хворих у стаціонарі.
Метою нашого дослідження було визначення діагностичних маркерів та способу прогнозування ХП у хворих на ЦД2.
Матеріали та методи
У дослідження були включені 94 (33 чоловіки та 61 жінка) хворі на ЦД2, середній вік — 58,94 ± 1,02 року. З цього числа 32 пацієнти з ізольованим ЦД2 (44 %) становили першу групу, а 62 пацієнти, яким був встановлений діагноз ХП (66 %), сформували другу групу. Верифікація діагнозу ХП проводилась на підставі стандартів обстеження хворих на ХП згідно з наказом МОЗ України № 638 від 10.09.2014 р. [6]. Діагноз ЦД2 встановлювався згідно з наказом МОЗ України № 1118 від 21.12.2012 р. [7].
Усім пацієнтам було проведено вимірювання маси тіла, росту. Оцінку трофологічного статусу проводили за рекомендаціями ВООЗ (1997) за індексом маси тіла (ІМТ). ІМТ визначався за формулою: ІМТ = маса тіла (кг)/ріст (м2), та вимірювався в кг/м2. Антропометричні вимірювання також включали визначення окружності талії (ОТ) та стегон (ОС), визначено їх відношення — ОТ (см)/ОС (см). Значення показника ОТ/ОС у жінок понад 0,85 та у чоловіків понад 0,90 свідчить про абдомінально-вісцеральне ожиріння.
Для верифікації діагнозу ХП та оцінки функціонального стану ПЗ використовували біохімічні та інструментальні методи дослідження. Функціональний стан ПЗ оцінювали за біохімічними показниками: вміст aльфа-амілази (за біохімічним методом), вміст фекальної панкреатичної еластази-1 (за імуноферментним методом). Для оцінки наявності та активності запального процесу в ПЗ визначали рівень С-реактивного протеїну (СРП) у сироватці крові за латексним методом. Концентрацію глюкози в сироватці крові натще (ГКН) визначали глюкозооксидазним методом, також визначали толерантність до глюкози. Показники ліпідного спектра сироватки крові (рівень загального холестерину (ЗХС) та тригліцеридів (ТГ)) визначали ензиматичним колориметричним методом. Вміст холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) розраховували за формулою W.T. Friedewald. Оцінка рівня інсулінорезистентності (ІР) проводилась за допомогою НОМА (homeostasis model assessment) — моделі оцінки гомеостазу з розрахуванням індексу ІР (НОМА-IR). При значенні НОМА-IR понад 2,77 діагностували наявність ІР.
Вміст у сироватці крові апеліну (С-термінального пептиду) та ФНП-a визначали імуноферментним методом (Raybiotech (США) та «Вектор-бест» (Росія) відповідно).
Дослідження ПЗ виконано за стандартною методикою за допомогою ультразвукової діагностичної системи Sonoline G-50. Вірогідними критеріями ХП при УЗД були зміни розмірів ПЗ, нерівний контур, неоднорідна ехоструктура, гетерогенне посилення ехогенності, розширення головного панкреатичного протоку (ГПП), кальцифікація та болючість при натисканні датчиком УЗД у зоні проекції ПЗ [4].
Статистичну обробку результатів дослідженя здійснювали з використанням пакетів програм Statisticа 6.0. Для порівняння середніх у групах використовувався критерій Манна — Уїтні [3], що не передбачає нормальність розподілу вибірок у кожній групі порівняння. Кореляційні зв’язки визначалися за допомогою непараметричного коефіцієнту Спірмена.
Завдання прогнозування ХП при ЦД2 вирішувалось за допомогою дискримінантного аналізу [8]. Такий аналіз передбачає визначення дискримінантних функцій, змінних, найбільш інформативних для класифікації об’єктів та побудови класифікаційних функцій для вирішення завдання класифікації.
Вибір дискримінантних змінних із 26 вхідних інтервальних предикторів (показників клінічних та лабораторних досліджень) здійснювався покроковим методом шляхом виключення (включення) вхідних змінних (предикторів) відповідно до їх рівня толерантності (міра надлишковості предиктору для класифікації). При цьому вхідні предиктори перевірялись на відсутність мультиколінеарності — сильної лінійної залежності між ними, що є обмеженням методу. В результаті були отримані класифікаційні функції YЦД2 та YЦД2 + ХП, які містили по п’ять вхідних предикторів.
Прогнозування ХП у хворих на ЦД2 здійснювалось шляхом обчислень значень класифікаційних функцій YЦД2 і YЦД2 + ХП для кожного хворого. При цьому хворий зараховувався до тієї групи (ЦД2 або ЦД2 + ХП), де класифікаційна функція була вищою.
Класифікаційні функції обчислювались за формулами:
YЦД2 = –152,65 + 0,68 «еластаза-1» +
+ 22,37 «HbA1С» + 0,09 «альфа-амілаза» –
– 0,54 «СРП» + 0,02 «апелін». (1)
YЦД2 + ХП = –121,95 + 0,59 «еластаза-1» +
+ 19,77 «HbA1С» + 0,17 «альфа-амілаза» –
– 0,38 «СРП» + 0,03 «апелін». (2)
При проведенні дискримінантного аналізу оцінювались значення стандартизованих коефіцієнтів канонічних коренів та матриці факторної структури, що дозволило оцінити значущість дискримінантних змінних у класифікації. Це дозволило ранжувати вибрані предиктори за їх важливістю в класифікацію в такому порядку: еластаза-1, СРП, апелін, aльфа-амілаза та НbA1c. Зокрема, можна стверджувати, що прогноз наявності ХП у хворих на ЦД2 значною мірою обумовлений зниженням значення еластази-1 та зростанням СРП, апеліну, aльфа-амілази та НbA1c.
Результати та їх обговорення
Нами вивчена частота ХП залежно від маси тіла у хворих на ЦД2. Встановлено, що ХП вірогідно частіше трапляється у хворих із підвищеною масою тіла (68 %) і тільки у 32 % пацієнтів із нормальною масою тіла (р < 0,05).
При оцінці трофологічного статусу пацієнтів із поєднаним перебігом ХП та ЦД2 значення ІМТ становило в середньому 29,46 ± 0,83 кг/м2, при цьому надмірна маса тіла була діагностована у 23 %, I ступінь ожиріння — у 26 %, II ступінь — у 15 % та III ступінь ожиріння — у 5 % хворих. ІМТ у пацієнтів із поєднаним перебігом ХП та ЦД2 на 23 % перевищував аналогічний показник хворих на ХП (р < 0,05) (табл. 1). Підвищення ІМТ у пацієнтів із поєднаним перебігом ХП та ЦД2 узгоджується з літературними даними щодо наявності взаємозв’язків між ліпоматозом ПЗ та масою пацієнта [2].
Аналіз співвідношення ОТ/ОС показав, що хворі обох досліджуваних груп мають абдомінальний тип відкладення жирової тканини (0,87 ± 0,02 та 0,87 ± 0,01 відповідно).
При вивченні функціонального стану ПЗ (табл. 1) показники рівнів еластази-1 у пацієнтів другої групи були вірогідно нижчі порівняно з першою групою (р < 0,05), що свідчило про взаємообтяжуючий характер метаболічних порушень при поєднаному перебігу захворювань та високий рівень формування фібротичних змін у ПЗ. Рівень СРП у сироватці крові хворих другої групи вірогідно перевищував значення у хворих першої групи (р < 0,05) та корелював з ІМТ (r = 0,41; р < 0,05), індексом ОТ/ОС (r = 0,49; р < 0,05), рівнем ГКН (r = 0,50; р < 0,05), рівнем НОМА-IR (r = 0,57; р < 0,05), рівнем ТГ (r = 0,58; р < 0,05), що свідчить про наявність системного запалення.
Зниження чутливості тканин до інсуліну за критерієм HOMA-IR спостерігалось у 94 % хворих обох груп. Встановлено, що рівень ІР у хворих другої групи корелював з еластазою-1 (r = –0,56; р < 0,05), СРП (r = 0,57; р < 0,05), що підтверджує значення ІР як одного з факторів розвитку та прогресування запалення у ПЗ. Кореляційний аналіз також виявив позитивні зв’язки між показниками HOMA-IR та ІМТ (r = 0,52; р < 0,05), а також рівнем ТГ (r = 0,34; р < 0,05). При гіперглікемії вільні радикали кисню утворюються безпосередньо з глюкози, що запускає каскад реакцій перекисного окиснення ліпідів та білків, при цьому зменшується перфузія крові у внутрішніх органах, у тому числі у ПЗ. Розвиток гіпоксії призводить до збільшення модифікованої атерогенної фракції ліпопротеїнів, пригнічення ферментативної ланки антиоксидантного захисту, внаслідок чого порушуються процеси апоптозу та активуються процеси системних метаболічних змін, результатом чого стає розвиток і прогресування пошкодження бета-клітин ПЗ [1]. Окрім цього, окисний стрес відіграє важливу роль у розвитку вогнищевого амілоїдного переродження клітин острівців ПЗ, що призводить до порушення інкреторної та екскреторної функцій ПЗ [1].
Порушення ліпідного обміну вірогідно частіше траплялися у хворих другої групи порівняно з пацієнтами першої групи (р < 0,05). При цьому у 79 % хворих другої групи була виявлена гіперхолестеринемія, у 93,5 % — підвищення рівня ХС ЛПНЩ, а зниження рівня ХС ЛПВЩ — у 87 % пацієнтів (р < 0,05), що підтверджується наявністю даних про те, що гіперхолестеринемія, асоційована з гіперамілаземією, може бути однією з причин стеатозу ПЗ [14]. Рівень ЗХС у хворих другої групи був вірогідно вищий, ніж у першій групі (р < 0,05). Рівень ТГ у сироватці крові пацієнтів другої групи в 1,2 раза перевищував показники пацієнтів першої групи (р < 0,05), що пов’язано з посиленим синтезом ТГ та ХС ЛПДНЩ у печінці, внаслідок чого синтезується і ХС ЛПНЩ, який відкладається у тканині ПЗ у тому числі. Підвищення концентрації ЗХС та ТГ у другій групі пацієнтів прямо залежало від ІМТ (r = 0,79, р < 0,05; r = 0,46, р < 0,05 відповідно), що пов’язано з прогресуванням метаболічних порушень у ПЗ, зокрема з надлишковим надходженням у ПЗ продуктів ліпідного обміну, що інфільтрують ацинарні клітини. Це підтверджує теорію впливу дисліпідемії на прогресування стеатозу ПЗ, який у результаті перетворюється на ХП [12].
При аналізі показників адипоцитокінів у другій групі хворих спостерігалось вірогідне підвищення рівнів апеліну та ФНП-aльфа в сироватці крові порівняно з першою групою (р < 0,05). У другій групі встановлені кореляційні взаємозв’язки між показниками ФНП-aльфа та еластазою-1 (r = –0,66; р < 0,05), а також СРП (r = 0,48; р < 0,05). Також у другій групі виявлені позитивні зв’язки між рівнями апеліну та ІМТ (r = 0,50; р < 0,05), співвідношенням ОТ/ОС (r = 0,55; р < 0,05), ЗХС (r = 0,38; р < 0,05), ХС ЛПНЩ (r = 0,38; р < 0,05) та ТГ (r = 0,56; р < 0,05), ГКН (r = 0,59; р < 0,05), індексом HOMA-IR (r = 0,70; р < 0,05), а також негативний зв’язок із ХС ЛПВЩ (r = –0,41; р < 0,05). Дані кореляційного аналізу свідчать про роль вивчених нами адипоцитокінів у розвитку функціональної недостатності ПЗ у хворих з поєднаним перебігом ХП та ЦД2.
За результатами прогнозування методом дискримінантного аналізу з урахуванням апостеріорної класифікації, тобто у випадку, коли наявність ХП у хворого на ЦД2 нам начебто невідома, можна судити про точність прогнозування на основі отриманих класифікаційних функцій. Зроблений аналіз для всієї вибірки хворих на ЦД2 (94 пацієнти) показав високу точність прогнозу (процент правильно передбачених випадків) на рівні 90,4 % (85 з 94). Результати цього аналізу наведені у табл. 2.
Прогностичну цінність запропонованого методу можна визначити й за такими критеріями, як:
— чутливість (процент правильно передбачених випадків ХП) — 93,55 % (58 з 62);
— специфічність (процент правильно передбачених випадків відсутності ХП) — 84,37 % (27 з 32).
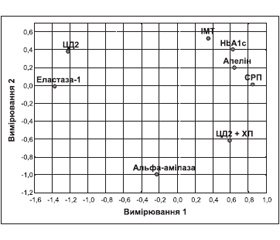
Якісну та кількісну інтерпретацію зв’язку між дискримінантними змінними та групами хворих можна зрозуміти за допомогою багатовимірного шкалювання — методу аналізу та спрощення геометричної структури даних [9]. На практиці це означає оцінку ступеня подібності між об’єктами (змінними) за близькістю метричних відстаней між ними або за кореляційними зв’язками. При цьому метод багатовимірного шкалювання позбавлений майже всіх обмежень вхідних змінних. Для спрощення розглядалися тільки дискримінантні функції та ІМТ. На рис. 1 подана двовимірна конфігурація 8-вимірного простору п’яти вхідних змінних, ІМТ та груп хворих: ЦД2 та ЦД2 + ХП. Аналіз діаграми Шепарда [9] показує належну якість підгонки моделі 8-вимірного простору до двовимірної конфігурації.
Слід відзначити, що виявлена схожість (близькість) між об’єктами (змінними) не завжди буде відповідати лінійним коефіцієнтам кореляції між ними. Але в даному випадку можна стверджувати, що для групи хворих на ЦД + ХП порівняно з групою ХП характерними є найбільш високі рівні СРП, aльфа-амілази й апеліну та найбільш низькі показники еластази-1. Також можна вказати на близькість (взаємозв’язок) таких показників, як СРП, апелін, НbA1c та ІМТ.
Висновки
1. При поєднаному перебігу ХП та ЦД2 відзначається вірогідне підвищення плазмових рівнів апеліну та ФНП-aльфа, а також погіршення показників вуглеводного, ліпідного обміну та функціонального стану ПЗ.
2. У хворих із коморбідною патологією встановлений зв’язок між рівнями апеліну, ФНП-aльфа та показниками вуглеводного, ліпідного обміну та функціонального стану ПЗ.
3. У результаті проведеного дослідження були виявлені основні діагностичні маркери ХП у хворих на ЦД2, до яких належать: СРП, aльфа-амілаза, апелін та еластаза-1, та розроблений спосіб прогнозування ХП у хворих на ЦД2.
Перспективи подальших досліджень полягають у розширенні розуміння змін у ПЗ на тлі ЦД2 та розробці й впровадженні нових методів діагностики та медикаментозної терапії поєднаного перебігу ЦД2 і ХП.
1. Губергриц Н.Б. Неалкогольная жировая болезнь поджелудочной железы / Н.Б. Губергриц, Т.Н. Христич, О.А. Бондаренко. — Донецк: ООО «Лебедь», 2013. — 236 с.
2. Ивашкин В.Т. Хронический панкреатит и стеатоз поджелудочной железы / В.Т. Ивашкин, О.С. Шифрин, И.А. Соколина. — М.: Литература, 2012. — 200 с.
3. Кобзарь А.И. Прикладная математическая статистика для инженеров и научных работников. — 2-е изд., испр. — М.: Физматлит, 2012. — 816 с.
4. Митьков В.В. Клиническое руководство по ультразвуковой диагностике: в 5 т. / В.В. Митьков. — М.: Видар, 2007. — Т. 5. — 360 с.
5. Рунион Р. Справочник по непараметрической статистике: современный подход / Пер. с англ. Е.З. Демиденко. — М.: Финансы и статистика, 1982. — 198 с.
6. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) медичної допомоги та медичної реабілітації «Хронічний панкреатит». Наказ Міністерства охорони здоров’я від 10.09.2014 р. № 638. — 34 с.
7. Уніфікований клінічний протокол первинної та вторинної (спеціалізованої) медичної допомоги «Цукровий діабет 2-го типу». Наказ Міністерства охорони здоров’я від 21.12.2012 р. № 1118. — 56 с.
8. Факторный, дискриминантный и кластерный анализ / Под ред. И.С. Енюкова. — М.: Финансы и статистика, 1989. — 215 с.
9. Халафян А.А. Statistica 6.0. Статистический анализ данных / А.А. Халафян. — М.: ООО «Бином-Пресс», 2007. — 3-е изд. — 512 с.
10. Anis M. Role of secretin-enhanced magnetic resonance cholangiopancreatography in the evaluation of patients following pancreatojejunostomy / M. Anis, K. Mortele // J. Clin. Imaging. Sci. — 2013. — Vol. 3(7). doi: 10.4103/2156–7514.107909.
11. Balci C. MRI assessment of chronic pancreatitis / C. Balci // Diagn. Interv. Radiol. — 2011. — Vol. 17(3). — P. 249–251.
12. Dobbins M. The Association between Obesity and Cancer Risk: A Meta-Analysis of Observational Studies from 1985 to 2011 / M. Dobbins, K. Decorby, B.C. Choi // ISRN Preventive Med. — 2011. — 680536. doi: 10.5402/2013/680536.
13. Gardner T.B. Pancreatic duct compliance after secretin stimulation: a novel endoscopic ultrasound diagnostic tool for chronic pancreatitis / T.B. Gardner, E.D. Purich, S.R. Gordon // Pancreas. — 2012. — Vol. 41(2). — P. 290–294.
14. Habchi M. Circulating apelin is increased in patients with type 1 or type 2 diabetes and is associated with better glycaemic control / M. Habchi, L. Duvillard, V. Cottet et al. // Clin. Endocrinol. (Oxf). — 2014. — Vol. 81(5). — P. 696–701.
15. Lindkvist B. Diagnosis and treatment of pancreatic exocrine insufficiency // World J. Gastroenterol. — 2013. — Vol. 19(42). — P. 7258–7266.
16. Manfredi R. Quantitative MRCP assessment of pancreatic exocrine reserve and its correlation with faecal elastase-1 in patients with chronic pancreatitis / R. Manfredi, S. Perandini, W. Mantovani et al. // Radiol. Med. — 2012. — Vol. 117(2). — P. 282–292.
17. Stevens T. Update on endoscopic pancreatic function testing / T. Stevens, M.A. Parsi // World J. Gastroenterol. — 2011. — Vol. 17(35). — P. 3957–3961.
18. Terzin V. Prevalence of exocrine pancreatic insufficiency in type 2 diabetes mellitus with poor glycemic control / V. Terzin, T. Várkonyi, A. Szabolcs et al. // Pancreatology. — 2014. — Vol. 14(5). — P. 356–360.
19. Vujasinovic M. Low prevalence of exocrine pancreatic insufficiency in patients with diabetes mellitus / M. Vujasinovic, J. Zaletel, B. Tepes et al. // Pancreatology. — 2013. — Vol. 13(4). — P. 343–346.

/27/27.jpg)
/28/28.jpg)