Международный эндокринологический журнал 3 (67) 2015
Вернуться к номеру
Вплив метаболічних порушень на клінічні прояви остеоартрозу та спосіб прогнозування його перебігу
Авторы: Олійник М.О., Журавльова Л.В. — Харківський національний медичний університет; Нессонова М.М. — Національний фармацевтичний університет, м. Харків
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета дослідження: вивчення впливу показників метаболічного синдрому на клінічні прояви остеоартрозу та розробка способу прогнозування тяжкості перебігу остеоартрозу залежно від компонентів метаболічного синдрому. Матеріали та методи. Були обстежені 84 хворі з остеоартрозом (20 чоловіків та 64 жінки), середній вік 57,03 ± 0,70 року. Результати. Встановлений зв’язок показників вуглеводного, ліпідного обміну, індексу маси тіла та абдомінального ожиріння з клінічними проявами остеоартрозу. Побудована модель дерева регресії для прогнозування сумарного бала за шкалою WOMAC залежно від характеристик метаболічного синдрому. Висновки. Отримані дані дозволяють зробити висновки про вплив інсулінорезистентності, дисліпідемії, артеріальної гіпертензії та абдомінального ожиріння на вираженість больового синдрому, обмеження рухливості та прояви фізичної активності у хворих на остеоартроз.
Цель исследования: изучение влияния показателей метаболического синдрома на клинические проявления остеоартроза и разработка способа прогнозирования тяжести остеоартроза в зависимости от компонентов метаболического синдрома. Материалы и методы. Были обследованы 84 больных с остеоартрозом (20 мужчин и 64 женщины), средний возраст 57,03 ± 0,70 года. Результаты. Установлена связь показателей углеводного, липидного обмена, индекса массы тела и абдоминального ожирения с клиническими проявлениями остеоартроза. Построена модель дерева регрессии для прогнозирования суммарного балла по шкале WOMAC в зависимости от характеристик метаболического синдрома. Выводы. Полученные данные позволяют сделать выводы о влиянии инсулинорезистентности, дислипидемии, артериальной гипертензии и абдоминального ожирения на выраженность болевого синдрома, ограничение подвижности и степень физической активности у больных остеоартрозом.
The objective of the research: to study the impact of metabolic syndrome parameters on the clinical signs of osteoarthritis and to develop the method for predicting osteoarthritis severity based on components of the metabolic syndrome. Materials and Methods. We have examined 84 patients with osteoarthritis (20 men and 64 women), average age was 57.03 ± 0.70 years. Results. The correlation between indicators of carbohydrate, lipid metabolism, body mass index and abdominal obesity and clinical manifestations of osteoarthritis has been established. The regression tree model has been created to predict the total WOMAC index depending on the characteristics of metabolic syndrome. Conclusions. The findings enable to draw conclusions about the impact of insulin resistance, dyslipidemia, hypertension and abdominal obesity on the severity of pain syndrome, limited mobility and manifestations of physical activity in patients with osteoarthritis.
остеоартроз, метаболічний синдром, індекс WOMAC, прогнозування.
остеоартроз, метаболический синдром, индекс WOMAC, прогнозирование.
osteoarthritis, metabolic syndrome, WOMAC index, prediction.
Статья опубликована на с. 53-58
Остеоартроз (ОА) посідає перше місце серед захворювань суглобів у багатьох популяціях земної кулі [1]. ОА характеризується хронічним прогресуючим перебігом, больовим синдромом різного ступеня вираженості з періодичними загостреннями, найчастіше трапляється в людей середнього та похилого віку, призводить до деформації суглобів, втрати їх функції та погіршення якості життя хворих [2]. ОА — одна з основних причин втрати працездатності та інвалідності. Однак справжнє його поширення складно оцінити внаслідок того, що пацієнти звертаються до лікаря лише за умов появи симптомів артропатії, а саме: болю, скутості, обмеження рухливості [3]. Частота ОА збільшується у 2–10 разів за період від 30 до 65 років і продовжує збільшуватися з віком.
ОА відносять до захворювань з одним із найвищих індексів коморбідності [3]. У низці досліджень було визначено, що ОА найчастіше поєднується з артеріальною гіпертензією (АГ), гіперхолестеринемією, атеросклерозом, ішемічною хворобою серця, ожирінням, цукровим діабетом (ЦД) 2-го типу, хронічними обструктивними захворюваннями легень, захворюваннями шлунково-кишкового тракту. ОА впливає на всі суглобові тканини, що призводить до формування різних клінічних фенотипів залежно від найбільш пошкодженої тканини в даний момент [4].
Особливу увагу викликає поєднання метаболічного синдрому (МС) та ОА. На сьогодні є багато досліджень, що свідчать про поєднання цих захворювань [5]. Кожна складова МС негативно впливає на перебіг ОА. Виділяють так званий метаболічний варіант ОА, що розвивається в пацієнтів з ожирінням, атеросклерозом, іншими метаболічними розладами й у більшості випадків є відображенням системних порушень метаболізму, які через прозапальні медіатори реалізуються в суглобі [6]. Патологічні зміни, що спостерігаються при ОА, включають деградацію суглобового хряща, ураження субхондральної кістки з утворенням остеофітів, персистуюче, різнорівневе запалення синовіальної оболонки, дегенерацію зв’язок і менісків, гіпертрофію суглобової капсули. Одночасно спостерігаються зміни в періартикулярних тканинах (м’язах, нервах, зв’язках, жировій тканині), що сприяють формуванню характерних симптомів ОА. Продемонстровано, що активація тих самих медіаторів запалення й білкових молекул призводить до залучення в патологічний процес і хряща, і синовіальної оболонки, і субхондральної кістки [7]. Є припущення, що інсулінорезистентність (ІР), ключова ланка МС, сприяючи збільшенню продукції глікованих сполук, викликає оксидантний стрес, який провокуює ендотеліальну дисфункцію [8]. Підвищене утворення кисневих радикалів та кінцевих продуктів глікування впливає на дисфункцію хондроцитів, а також деструкцію субхондральної кістки [9]. Було висунуто припущення, що ІР може бути ключовою патогенетичною ланкою не тільки при ЦД 2-го типу й АГ, а й при ОА [10]. Вважається, що пошкодження, спричинені вільними радикалами, роблять істотний внесок у розвиток як атеросклерозу, так і захворювань суглобів. Виявлено тісну кореляцію між вмістом тригліцеридів (ТГ) і здатністю фагоцитів синтезувати фактор некрозу пухлини a, місцева продукція якого у вогнищі запалення забезпечує хемотаксис нейтрофілів, їх дегрануляцію, продукцію й секрецію ними активних форм кисню, посилення фагоцитозу. Важливу роль дисліпідемії в розвитку ОА доводить високий рівень ТГ у хворих із повною втратою хряща за даними артроскопії та його кореляція з циркулюючими імунними комплексами. Був виявлений взаємозв’язок між дисліпідемією й окислювальним стресом та ерозивними змінами в хрящі [11]. З урахуванням вищезазначеного вивчення впливу метаболічних змін на перебіг ОА є перспективним напрямком. Для оцінки тяжкості перебігу ОА, визначення специфічних симптомів та обмеження функції суглобів використовують вимірювальні шкали, зокрема індекс WOMAC [12]. WOMAC-індекс (Western Ontario and McMaster University) для артрозу — загальноприйнята шкала для оцінки симптомів гонартрозу (функціональності) самим пацієнтом за допомогою 24 питань. Усі питання розподілені по трьох розділах. Перша субшкала містить 5 питань, дозволяє оцінити больову симптоматику; друга субшкала (2 питання) — вираженість ригідності суглобів; третя субшкала (17 питань) стосується проявів фізичної активності та обмеження рухливості колінних суглобів. Відповіді на ці запитання дає сам пацієнт, при цьому використовується візуально-аналогова шкала (ВАШ) — від 0 (немає симптомів/обмежень) до 10 (максимальна вираженість симптомів/обмежень), і потім всі показники підсумовуються. Тому ця шкала — досить інформативний показник функціонального стану суглобів пацієнта.
Мета дослідження — вивчення впливу показників метаболічного синдрому на клінічні прояви остеоартрозу та розробка способу прогнозування тяжкості перебігу ОА залежно від компонентів метаболічного синдрому.
Матеріали та методи дослідження
В умовах ревматологічного та ендокринологічного відділень КЗОЗ «Обласна клінічна лікарня — центр екстреної медичної допомоги та медицини катастроф» м. Харкова були обстежені 84 хворі на ОА. Середній вік хворих становив 57,03 ± 0,69 року. Контрольну групу становили 20 практично здорових осіб.
Клінічне обстеження пацієнтів включало аналіз скарг, збір анамнезу, фізикальний огляд та оцінку антропометричних показників — росту, маси тіла, окружності талії (ОТ), окружності стегон (ОС), визначення індексу маси тіла (ІМТ = маса тіла (кг)/ріст (м)2) та співвідношення ОТ/ОС. Відповідно до загальноприйнятих критеріїв при визначенні ОТ > 94 см у чоловіків та > 80 см у жінок було констатовано абдомінальне ожиріння. Згідно з індексом Кетле діагноз «ожиріння» встановлювався хворим при ІМТ ≥ 30 кг/м2 .
Діагноз ОА колінних суглобів встановлювали на основі діагностичних критеріїв ACR (1991) [3]. Проводилось клінічне та інструментальне обстеження пацієнтів. Дослідження суглобів включало огляд, пальпацію, об’єктивну оцінку болю в спокої та при рухах за ВАШ. Симптоми ОА оцінювали за індексом WOMAC. Рентгенологічне обстеження виконувалось за допомогою рентгенологічного обладнання КРД-50 «Індіаком-02» та РУМ-20-2П2. Рентгенологічні стадії ОА оцінювали за класифікацією J.H. Kellgren та J.S. Lawrens.
Діагностику ЦД 2-го типу та МС проводили згідно з критеріями Міжнародної діабетичної федерації (IDF, 2005). Верифікація діагнозу «цукровий діабет 2-го типу» проводилась на основі Уніфікованого клінічного протоколу спеціалізованої медичної допомоги: ЦД 2-го типу (2012). Концентрацію глюкози в сироватці крові натще (ГКН) визначали глюкозооксидантним методом, також визначали толерантність до глюкози. Показники ліпідного спектра сироватки крові (рівень загального холестерину (ЗХС) і ТГ визначали ензиматичним колориметричним методом. Уміст холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) розраховували за формулою W.T. Friedewald:
ХС ЛПНП = ЗХС – (ХС ЛПВЩ – ТГ/2,2).
Рівень ХС ЛПДНЩ визначали за допомогою формули:
ХС ЛПДНЩ = ТГ/2,18.
Оцінка рівня ІР проводилась за допомогою НОМА (homeostasis model assessment) — моделі оцінки гомеостазу з розрахуванням індексу ІР (НОМА-IR) за формулою:
HOMA-IR = інсулін (мкОД/мл) x глюкоза (ммоль/л)/22,5.
При значенні НОМА-IR понад 2,77 діагностували наявність ІР.
Статистична обробка результатів досліджень включала попередню обробку даних, видалення викидів (застосовувався критерій Тьюкі), перевірку нормальності розподілів досліджуваних показників (застосовувався критерій Шапіро — Уїлка). Оскільки більшість кількісних показників не мала нормального розподілу, як описові статистичні характеристики використовувалися як параметричні, так і непараметричні статистики: для опису центральних тенденцій обраховувались вибіркові середні та медіани, для опису розкиду значень — стандартні похибки середнього й квартилі. Для здійснення двовибіркових порівнянь значень кількісних показників в групах, що визначалися діагнозом, використовувався критерій Манна — Уїтні. Для перевірки значущості розбіжностей значень кількісних показників у трьох групах використовувався непараметричний дисперсійний аналіз Краскела — Уолліса з подальшими попарними порівняннями груп за допомогою двовибіркового критерію Манна — Уїтні з поправкою Бонферроні на множинність порівнянь. Оцінка сили взаємозалежності між показниками вуглеводного, ліпідного обміну та клінічною картиною перебігу ОА проводилася методами кореляційного аналізу, а саме обчислювалися рангові кореляції Спірмена (r).
У цій роботі будувалася модель прогнозування сумарного бала за шкалою WOMAC залежно від характеристик МС: ОТ, HbA1c, ХС ЛПНЩ, ТГ, значення артеріального тиску (АТ). Додатково як предиктори тяжкості ОА використовувалися такі показники, як вік пацієнтів і тривалість основного захворювання (ОА). Найкраща (у плані найбільшої точності) модель була отримана за допомогою техніки побудови дерев регресії з використанням методу CART (Classification And Regression Trees) з вибором правила зупинки за методом FACT з часткою некласифікованих спостережень не більше ніж 1 %.
Усі обчислення проводились за довірчої ймовірності 95 %, тобто при отриманні обчислених значень р < 0,05 результати вважалися статистично значущими. Більшість обчислень та побудова моделі дерева регресії проводилася з використанням програмного пакета StatSoft Statisticа, версія 6.0.
Результати та їх обговорення
При оцінці антропометричних даних пацієнтів з ОА встановлено, що значення ІМТ пацієнтів з ОА в середньому становили 30,07 ± 0,76 кг/м2 та перевищували цей показник у контрольній групі (M – W •Z = –5,16351, p < 0,05) (табл. 1).
При цьому надлишкову вагу тіла було діагностовано у 25 %, I ступінь ожиріння — у 16,7 %, II ступінь — у 15,4 % та III ступінь ожиріння — у 9,5 % хворих. Підвищення ІМТ узгоджується з літературними даними щодо ролі ожиріння в розвитку ОА. Було встановлено, що ОА частіше трапляється у хворих із підвищеною масою тіла (67 %) і в 33 % — з нормальною масою тіла. Абдомінальне ожиріння було виявлено в 65,5 % пацієнтів (у 65 % чоловіків та 64 % жінок).
При аналізі показників АТ було виявлено, що підвищений АТ спостерігався у 65,5 % хворих, з них пацієнтів з АГ I ступеня — 67 %, II — 33 % хворих.
При аналізі показників вуглеводного обміну було виявлено ЦД у 75 % хворих. Визначено, що рівень ГКН корелював з ІМТ (r = 0,77 р < 0,05), ОТ (r = 0,64; р < 0,05), співвідношенням ОТ/ОС (r = 0,60; р < 0,05) та показниками АТ: САТ (r = 0,57; р < 0,05), та ДАТ (r = 0,53; р < 0,05). Рівень НbA1c корелював з ІМТ (r = 0,72 р < 0,05), ОТ (r = 0,63; р < 0,05), співвідношенням ОТ/ОС (r = 0,64; р < 0,05). Кореляційний аналіз також виявив значні позитивні зв’язки між показниками HOMA-IR та ІМТ (r = 0,88; р < 0,05), ОТ (r = 0,78; р < 0,05), співвідношенням ОТ/ОС (r = 0,74; р < 0,05) та показниками САТ (r = 0,53; р < 0,05), та ДАТ (r = 0,47; р < 0,05). ІР сприяє збільшенню продукції глікованих сполук, спричинює підвищене утворення кисневих радикалів, що впливають на дисфункцію хондроцитів, а також деструкцію субхондральної кістки [19].
Вивчення показників ліпідного обміну виявило, що дисліпідемія траплялася у 85 % хворих. При цьому в 94 % хворих була виявлена гіперхолестеринемія, у 77,5 % — підвищення ТГ, у 78 % — підвищення ХС ЛПНЩ (р < 0,05). Спостерігався виражений зв’язок між ЗХС та співвідношенням ОТ/ОС (r = 0,52; р < 0,05), показниками САТ (r = 0,73; р < 0,05) та ДАТ (r = 0,59; р < 0,05). Було визначено зв’язок показників ліпідного обміну з ІМТ, а саме ЗХС (r = 0,66; р < 0,05), ТГ (r = 0,50; р < 0,05), ХС ЛПНЩ (r = 0,49; р < 0,05). Пряма залежність спостерігалась між ОТ та підвищенням концентрації ЗХС (r = 0,56; р < 0,05), ХС ЛПНЩ (r = 0,37; р < 0,05), та ТГ (r = 0,58; р < 0,05). Спостерігався зв’язок між показниками ліпідного та вуглеводного обміну, а саме між ЗХС та ГКН (r = 0,52; р < 0,05), НbA1c (r = 0,42; р < 0,05), ІРІ (r = 0,45; р < 0,05), індексом HOMA-IR (r = 0,52; р < 0,05); ТГ та ГКН (r = 0,42; р < 0,05), НbA1c (r = 0,42; р < 0,05), ІРІ (r = 0,42; р < 0,05), індексом HOMA-IR (r = 0,47; р < 0,05); ХС ЛПНЩ та ГКН (r = 0,36; р < 0,05), НbA1c (r = 0,24; р < 0,05), ІРІ (r = 0,29; р < 0,05), індексом HOMA-IR (r = 0,35; р < 0,05). Це підтверджує дані, що під впливом ІР відбувається зміна активності ліпопротеїнліпази й печінкової тригліцеридліпази, що призводить до збільшення синтезу й секреції ЛПДНЩ, порушення їх елімінації, відбувається збільшення рівня ліпопротеїнів, збагачених ТГ, концентрації ХС ЛПНЩ і зниження ХС ЛПВЩ, підвищення синтезу й секреції аполіпопротеїну-В.
При аналізі впливу показників МС на індекс WOMAC було виявлено значний вплив цих показників на клінічний перебіг ОА, а саме визначено значний кореляційний зв’язок між індексом WOMAC та ОТ (r = 0,48; р < 0,05), САТ (r = 0,56; р < 0,05), рівнем ХС ЛПНЩ (r = 0,35; р < 0,05), ТГ (r = 0,24; р < 0,05), HbA1с (r = 0,54; р < 0,05), тривалістю ОА (r = 0,24; р < 0,05). З урахуванням цих даних була побудована модель дерева регресії для прогнозування сумарного бала за шкалою WOMAC залежно від характеристик МС: ОТ, HbA1с, ХС ЛПНЩ, ТГ, значення АТ. Додатково як предиктори тяжкості ОА використовувалися показники віку пацієнтів і тривалості ОА. Вирішальні правила прогнозування сумарного бала за шкалою WOMAC на основі побудованої моделі показані на рис. 1.
Модель дерева регресії розбиває множину пацієнтів на підмножини, що не перетинаються. Вони характеризуються певними діапазонами значень, які, у свою чергу, пояснюють змінні, і кожній такій підмножині пацієнтів відповідає значення сумарного бала шкали WOMAC. При використанні цього методу можливо з ймовірністю 86,1 % спрогнозувати вираженість больового синдрому та недостатність функції суглобів, тобто визначити кількість балів, що отримає пацієнт за шкалою WOMAC, без проведення опитування, а тільки використовуючи вищевказані показники МС.
Коефіцієнт детермінації для побудованої моделі R2 = 0,861125, тобто виділені правила на 86,1 % пояснюють мінливість змінної «сумарний бал WOMAC» залежно від значень розглянутих пояснюючих змінних. Середня відносна похибка MAPE = 0,0550915, тобто модель помиляється в середньому на 5,51 %. Середня абсолютна похибка MAD = 5,548951, тобто прогноз моделі в середньому помиляється на 5,5 бала. Кореляційне відношення n = 0,861125 говорить про достатньо сильний зв’язок між реальними та спрогнозованими даними.
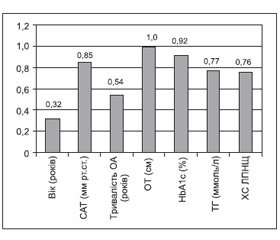
Важливість пояснюючих змінних, що використовувались для побудови моделі прогнозування, подано на рис. 2.
/57/57.jpg)
Було виявлено, що найбільш важливими змінними для прогнозування сумарного бала за WOMAC є ОТ та рівень HbA1с, дещо менш важливий САТ, потім рівні ТГ та ХС ЛПНЩ. Найменш важливими змінними в даній моделі є тривалість ОА та вік пацієнта.
Висновки
1. Виявлено зв’язок індексу WOMAC з показниками метаболічного синдрому, а саме з абдомінальним ожирінням, рівнем HbA1с, САТ, ХС ЛПНЩ та ТГ.
2. У хворих з ОА та метаболічним синдромом найбільший вплив на вираженість больового синдрому, обмеженість функції суглоба та зниження фізичної активності й обмеження рухливості можуть мати абдомінальне ожиріння та порушення вуглеводного обміну.
3. У результаті проведеного дослідження побудована модель дерева регресії для прогнозування сумарного бала за шкалою WOMAC залежно від характеристик метаболічного синдрому.
1. Васильева Л.В. Остеоартроз и метаболический синдром — современное видение проблемы / Л.В. Васильева, Д.И. Лахин // Вестник новых медицинских технологий. — 2012. — Т. ХIХ, № 4. — С. 40.
2. Галушко Е.А. Остеоартроз в амбулаторной практике / Е.А. Галушко, Ш.Ф. Эрдес, Л.И. Алексеева // Современная ревматология. — 2012. — № 4. — C. 66–70.
3. Головач И.Ю. Остеоартрит: фундаментальные и прикладные аспекты этиопатогенеза заболевания. Ничего не стоит на месте / И.Ю. Головач // Український ревматологічний журнал. — 2014. — № 2 (56). — C. 4–11.
4. Изучение качества жизни как фактора оценки эффективности применения общей магнитотерапии в восстановительном лечении больных остеоартрозом / А.В. Александров, В.К. Дегтярев, Н.В. Ненашева [и др.] // Фундаментальные исследования. — 2012. — № 7. — C. 259–263.
5. Коваленко В.М. Остеоартроз. Практична настанова / В.М. Коваленко, О.П. Борткевич. — К.: Моріон, 2010. — 608 с.
6. Національний підручник з ревматології / За ред. В.М. Коваленка, Н.М. Шуби. — К.: Моріон, 2013. — 672 с.
7. Accumulation of metabolic risk factors such as overweight, hypertension, dyslipidaemia, and impaired glucose tolerance raises the risk of occurrence and progression of knee osteoarthritis: a 3-year follow-up of the ROAD study / N. Yoshimura, S. Muraki, H. Oka [et al.] // Osteoarthritis and Cartilage. — 2012. — Vol. 20, Issue 11. — P. 1217–1226.
8. Berenbaum F. Diabetes-induced osteoarthritis: from a new paradigm to a new phenotype / F. Berenbaum // Ann. Rheum. Dis. — 2011. — Vol. 70. — P. 1354–1356.
9. Gabriel Sh.E. Review Epidemiological studies in incidence, prevalence, mortality and comorbidity of the rheumatic diseases / Sh.E. Gabriel, K. Michaud // J. Arthr. Res. Ther. — 2009. — Vol. 11. — P. 229.
10. Metabolic syndrome meets osteoarthritis / Q. Zhuo, W. Yang, J. Chen [et al.] // Nat. Rev. Rheumatol. — 2012. — Vol. 8. — P. 729–737.
11. Metabolic syndrome, advanced glycation end products and knee osteoarthritis progression: a report from OAI / C.B. Eaton, S.M. Sayeed, M. Roberts [et al.] // Osteoarthritis and Cartilage. — 2013. — Vol. 21, Issue 11. — P. 165–166.
12. Metabolic triggered inflammation in osteoarthritis / X. Wang, D. Hunter, J. Xu [et al.] // Osteoarthritis and Cartilage. — 2015. — Vol. 23. — P. 22–30.

/55/55.jpg)
/56/56.jpg)