Международный эндокринологический журнал 3 (67) 2015
Вернуться к номеру
Современные принципы ведения пациентов с синдромом диабетической стопы и критической ишемией нижних конечностей
Авторы: Татьяна Чистик
Рубрики: Эндокринология
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 99-104
С каждым годом в мире возрастает число людей с сахарным диабетом (СД). Эпидемиологи прогнозируют, что к 2025 году их число увеличится до 330 млн. В Украине этот показатель составляет 2,2 %, однако исследование «Диа Скрин» указывает, что реальная цифра таких больных намного выше — 13,69 % [1].
Синдром диабетической стопы (СДС) является одним из наиболее социально значимых осложнений СД, поскольку развивается у каждого шестого пациента с сахарным диабетом. Но актуальность данной проблемы обусловлена не только распространенностью этого осложнения. СДС — серьезный фактор риска ампутации нижних конечностей, причина высокой инвалидизации и смертности больных СД.
Если еще несколько лет назад, приводя статистические показатели, эксперты отмечали, что каждые полторы минуты в мире выполняется ампутация нижней конечности, связанная с СД, то сегодня этот временной интервал уменьшился [2]. Установлено, что риск ампутации после возникновения СДС в 25 раз выше, чем в общей популяции [3]. В свою очередь, длительное наблюдение за больными, перенесшими ампутацию, показало, что послеоперационная смертность среди них достигает 6 %, смертность в течение первых 5 лет — 39–68 % [4]. Также следует отметить, что после перенесенной ампутации одной нижней конечности у 42 % пациентов в течение первых 3 лет возникает необходимость в проведении ампутации второй ноги [4].
Таким образом, проблема адекватного консервативного лечения пациентов с хроническими раневыми дефектами нижних конечностей и предотвращения возможной ампутации сохраняет свою актуальность.
23–24 апреля в г. Киеве состоялась научно-практическая конференция с международным участием «Сухаревские чтения: ангиология и сосудистая хирургия сегодня», в рамках которой были рассмотрены важнейшие вопросы дифференциального подхода к терапии трофических язв, синдрома диабетической стопы, хронической и критической ишемии нижних конечностей (КИНК) у больных сахарным диабетом.
С докладом «Особенности дифференциального подхода к терапии трофических язв у больных сахарным диабетом» выступила доцент кафедры диабетологии НМАПО им. П.Л. Шупика, руководитель подразделения диабетической стопы Института эндокринологии и обмена веществ им. В.П. Комиссаренко Cветлана Викторовна Болгарская.
Сахарный диабет — это серьезная медико-социальная проблема, сопровождающаяся неуклонным ростом заболеваемости, инвалидизацией и занимающая «почетное» третье место среди непосредственных причин смерти. Более 230 млн человек в мире страдают диабетом, в США этот показатель составляет 20,8 миллиона [5]. Около 25 % пациентов с сахарным диабетом на протяжении жизни сталкиваются с проблемами в области нижних конечностей. При этом, по данным Rogers et al. (2008), на лечение пациентов с сахарным диабетом и синдромом диабетической стопы ежегодно тратится более 19 млн долларов, а на ампутации — 11 млн долларов [6]. Также подсчитано, что правильно проведенная профилактика и обучение пациентов с данной патологией позволяют сократить расходы на 21 млн долларов.
Известно, что к главным причинам, влияющим на развитие трофических поражений нижних конечностей у больных СД, относятся диабетическая полинейропатия (ДПН) (в 78 % случаев), сочетание нейропатии, деформации и травмы (критическая триада — 63 %), ишемический компонент (35 %). Причем более 80 % всех язвенных поражений нижних конечностей предотвратимы (Reiber et al., 1999).
Для стратифицирования рисков и понимания серьезности язвенно-некротического процесса стоп существует ряд классификаций, таких как система Мeггитт — Вагнера, система, принятая в университете Техаса (УТ), и SAD-система. УТ-система — это расширенная, хорошо известная система Вагнера, включающая в себя определение глубины изъязвлений и наличие ишемии и инфекции, также по ней можно оценивать риск ампутации (Armstrong et al., 1998). Одним из важных пунктов этой системы является определение неблагоприятного прогноза сочетания «ишемия + инфекция».
Другой классификацией, принятой Международной диабетической федерацией (IDF) в 2007 году, является PEDIS-система.
— Перфузия (Р): кровоснабжение конечности — норма/умеренная ишемия/критическая ишемия стопы.
— Протяженность (Е): размер тканевого дефекта (площадь, см2).
— Глубина (D): поверхностная/подкожная, без вовлечения кости/глубокая, с вовлечением кости.
— Инфицирование (I): нет инфицирования/поверхностное инфицирование/поверхностная или локализованная инфекция/глубокая/системная.
— Чувствительность (S): нормальная/патологическая.
В большинстве случаев причиной СДС является периферическая сенсорная, моторная и вегетативная нейропатия. Хроническая сенсомоторная нейропатия — наиболее часто встречающееся осложнение. Она характеризуется снижением болевой, температурной и вибрационной чувствительности. И образование язв зачастую связано именно со снижением порога болевой чувствительности, потеря которой приводит к тому, что пациент перестает адекватно реагировать на травматические воздействия: может встать, например, на острый предмет либо получить термический ожог стоп и не ощутить этого.
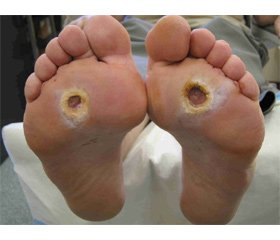
Типичная нейропатическая язва представляет собой дефект ткани, окруженный гиперкератозом, безболезненный даже при обработке, имеющий длительный анамнез течения. Для заживления нейропатической язвы необходимы контроль инфекции, разгрузка нижней конечности и адекватное местное лечение.
Учитывая, что язвы у пациентов с сахарным диабетом — входные ворота инфекции, которая при СД распространяется довольно быстро, вызывая септические состояния, назначение антибактериальной терапии проводится в довольно ранние сроки, и даже при неглубоких поражениях, с продолжительностью от 14 дней до 6 месяцев. При этом следует помнить, что длительно существующая язва нередко имеет сформированную биопленку — сообщество микроорганизмов в матриксе из полимеров (мукополисахаридов), выделяемых бактериями. Для подготовки раны к пластике необходимо удаление биопленки, которое проводится методом ультразвуковой кавитации либо с помощью ВАК-терапии.
Также важным аспектом успешного лечения нейропатической язвы является проведение разгрузки нижней конечности, включающей мероприятия по соблюдению постельного режима до наложения различных гипсовых повязок и удаления остеофитов. По данным Н.С. Свиридова, перспективным направлением является комплексное применение кожно-жировой пластики с парентеральным введением Актовегина, что обеспечивает заживление даже обширных язвенных дефектов [7].
Следует отметить, что интерес к применению Актовегина при ДПН связан с тем, что препарат обладает антиоксидантными свойствами и способностью улучшать утилизацию кислорода и глюкозы клетками, что крайне важно при СД, когда в тканях формируется энергетическая недостаточность, связанная как с феноменом псевдогипоксии, так и с истинной гипоксией.
В 2009 г. были опубликованы результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования лечения больных СД 2-го типа с ДПН препаратом Актовегин [8]. Целью исследования была оценка клинической эффективности и безопасности Актовегина по сравнению с плацебо у пациентов с СД 2-го типа и клиническими проявлениями периферической диабетической полинейропатии после внутривенных инфузий Актовегина или плацебо с последующим переходом на прием пероральных форм.
В исследование было включено 567 больных, из которых 281 пациенту проводилось лечение Актовегином, а 286 — плацебо.
К основным критериям эффективности препарата в этом исследовании относилась положительная невропатическая симптоматика, оцениваемая по шкале TSS, и порог вибрационной чувствительности, тестируемый в нескольких точках на ногах (лодыжка, пальцы стопы) с помощью биотензиометра. Вторичными критериями эффективности служили отдельные показатели шкалы TSS, шкала NIS-LL и показатели качества жизни (краткая шкала — SF 36).
В ходе исследования наилучшие результаты отмечены в отношении позитивной невропатической симптоматики, причем улучшение отмечалось как по суммарной оценке всех симптомов, так и в отношении каждого конкретного симптома. Выявлено достоверное уменьшение сенсорного неврологического дефицита, в отношении изменения рефлексов и силы мышц отмечена положительная тенденция к улучшению.
Объективные показатели состояния проприоцептивных нервных волокон у пациентов, получающих Актовегин, продемонстрировали достоверное уменьшение порога вибрационной чувствительности.
Таким образом, были сделаны выводы, что последовательная внутривенная, а затем пероральная терапия Актовегином в течение 160 дней улучшает симптомы невропатии, снижает порог вибрационной чувствительности и улучшает сенсорную функцию у пациентов с СД 2-го типа и диабетической полинейропатией.
В собственном исследовании, проведенном на базе Института эндокринологии и обмена веществ им. В.П. Комиссаренко, с участием 60 пациентов с СД и ДПН и сохраненным магистральным кровотоком, было показано, что прием Актовегина на 30 % улучшает жизнеспособность кожных покровов, проведение импульса по нервному волокну и уменьшает неврологический дефицит [9].
В недавнем исследовании M.W. Еlminger выявлено, что Актовегин уменьшает апоптоз (по активности каспазы-3), увеличивает число синаптических связей и дозозависимо уменьшает оксидативный стресс в нейронах [10]. В исследовании A. Dieckmann с соавт. обнаружено, что Актовегин улучшает проведение возбуждения по чувствительным волокнам и уменьшает апоптоз в волокнах седалищного нерва за счет уменьшения активности PARP, что подчеркивает влияние Актовегина на патогенетические механизмы формирования клеточного поражения при СД [11]. Также было установлено, что Актовегин достоверно увеличивает плотность интраэпидермальных нервных волокон и кровоток в vasa nervosum, уменьшает тактильную аллодинию и нормализует температурную чувствительность (Jensen W. et al.) [12].
С докладом «Особенности диагностики и ведения пациентов с хронической ишемией нижних конечностей и критической ишемией нижних конечностей в условиях сопутствующего сахарного диабета» выступил доктор медицинских наук, профессор, заведующий кафедрой госпитальной хирургии Львовского национального медицинского университета им. Данила Галицкого Игорь Иванович Кобза.
Критическая ишемия нижних конечностей, как правило, в 40–70 % случаев вызвана сахарным диабетом либо сопутствует ему. К ее основным клиническим формам относятся: ишемическая (60–80 %), нейроишемическая (55–70 %) и нейропатическая (80–90 %) формы [20].
Клинической особенностью КИНК (ESC Guidelines, 2011) является боль покоя с преимущественной локализацией в пальцах и стопах, особенно при подъеме конечностей, а также развитие ишемических поражений в пальцах, кончиках пальцев и пятках [21].
Согласно методическим рекомендациям Ассоциации кардиологов и кардиохирургов Украины (2012), ESC Guidelines (2011), в качестве первой линии для диагностики КИНК применяют такие неинвазивные методы, как изменение сегментарного САД, запись пульсовой волны, плетизмография, допплеровская флоуметрия и ультразвуковое дуплексное сканирование [22, 23]. При величине лодыжечно-плечевого индекса более 1,40 в качестве альтернативных диагностических мероприятий могут быть предложены исследование пальцеплечевого индекса и анализ допплеровского сигнала (класс I, уровень доказательности В). Для определения локализации заболеваний артерий нижних конечностей может быть осуществлена компьютерная томография, МРТ-ангиография (класс I, уровень доказательности А).
Также важным аспектом является проведение дифференциальной диагностики между нейропатической и ишемической формой КИНК. Для нейропатической формы характерно наличие сохраненной пульсации на артериях нижних конечностей, отсутствие боли при движении и в покое, нарушение чувствительности. Кожа пораженная, теплая на ощупь. Присутствуют деформации, лимфатические нарушения и отек нижней конечности. Гангрена влажная либо сухая.
Ишемическая форма сопровождается отсутствием пульсации на артериях нижней конечности, выраженным болевым синдромом как при движении, так и в состоянии покоя, сохранностью чувствительности. Кожные покровы холодные, структура кожи не изменена. Деформации отсутствуют, однако могут быть лимфатические нарушения, сопровождающиеся отеком конечности; гангрена сухая.
К необходимым терапевтическим мероприятиям при критической ишемии нижних конечностей в сочетании с сахарным диабетом относятся: влияние на факторы риска; иммунотерапия и системное лечение; оптимальное лечение диабетической стопы и проведение реваскуляризации.
Влияние на факторы риска осуществляется соблюдением диеты, прекращением курения, нормализацией гипертензии и липидного обмена, а также назначением дезагрегантов. По данным A.W. Gardner (1996), прекращение курения уменьшает возможность перехода хромоты в КИНК, частоту ампутаций и сердечно-сосудистых осложнений (инфаркта миокарда, инсульта и смерти), а также увеличивает дистанцию ходьбы без боли [24]. Нормализация гипертензии достигается подбором адекватной антигипертензивной терапии, при этом бета-блокаторы не должны назначаться рутинно, так как увеличивают риск инсульта, брадикардии и гипотензии (Devereaux P.J. et al., 2008) [25]. Для номализации липидного обмена показано назначение статинов, положительный эффект которых был изучен в метаанализе К. Hindler et al. (2006) [26]. Было проанализировано 15 исследований, в которых приняли участие 223 010 человек с сахарным диабетом, перенесших сосудистые операции. Результаты метаанализа продемонстрировали эффективность данной терапии, так как снижение смертности после операций на сосудах составило 59 %. Изучение эффективности дезагрегантов проводилось в исследовании РOPADAD (Belch J.J. et al., 2008) [27]. В нем приняли участие 1276 пациентов с СД 1-го или 2-го типа и асимптомной перемежающейся хромотой (ПХ). Конечными точками служили сердечно-сосудистые осложнения: смерть и ампутация нижней конечности. Данное исследование показало, что назначение аспирина в этой группе больных не эффективно. Подобные результаты были получены и в метаанализе, проведенном G. De Berardis et al. (2009), что позволило авторам сделать заключение о нецелесообразности профилактического назначения аспирина пациентам, страдающим сахарным диабетом [28].
Появление цилостазола стало серьезным прорывом в терапии ПХ. Еще в 1988 году он был одобрен в Японии для лечения язв и боли, причиненных перемежающейся хромотой (Kambayashi J. et al., 2003) [29]. В многоцентровом рандомизированном исследовании D.I. Dawson et al. (1998) было показано, что его применение у пациентов с СД и ПХ снижает риск ампутации нижней конечности и улучшает симптомы заболевания [30]. В метаанализе D. Geng et al. (2012), включающем 5 рандомизированных исследований, установлено, что цилостазол, назначавшийся по 100 мг 2 раза в день в течение 3–6 месяцев, существенно увеличивал как протяженность дистанции, проходимой до появления болей в ногах, так и максимальной проходимой дистанции (МПД), причем последний показатель возрастал на 33–82 % (р < 0,01–0,001) [31]. Увеличение МПД наблюдалось и при применении препарата в дозе 50 мг 2 раза в день. При прямом сравнении в одном из исследований цилостазол по эффективности значительно превосходил пентоксифиллин (Dawson D.L., 2000) [32]. По данным анкетирования, цилостазол во всех исследованиях благоприятно влиял на функциональное состояние больных и повышал качество их жизни. Еще одним объективным подтверждением эффективности этого препарата при ПХ стало замедление прогрессирования атеросклероза сонных артерий и улучшение липидного профиля [33].
Инсулинотерапия — важный аспект предупреждения и лечения КИНК. В исследовании DCCT (исследование контроля диабета и его осложнений) с участием 1441 больного с сахарным диабетом 1-го типа все пациенты были разделены на 2 группы [34]. Первая группа включала 726 человек без осложнений (группа первичной профилактики), 2-я — 715 человек с признаками диабетической ретинопатии (группа вторичной профилактики). В каждой группе одним пациентам назначалась традиционная терапия, а другим — интенсивная. Продолжительность наблюдения за больными колебалась от 3 до 9 лет (средняя продолжительность — 6,5 года). На протяжении всего исследования уровень гликированного гемоглобина в группе интенсивного лечения поддерживался на уровне, близком к 7 %, тогда как в группе с традиционной инсулинотерапией он был около 9 % (то есть таким же, как исходный). Было показано, что развитие и прогрессирование диабетической ретинопатии в группе интенсивной терапии снизилось почти на 60 %, тяжелой непролиферативной и пролиферативной ее форм, требующих лазеркоагуляции, — на 50 %. В результате интенсивной терапии на 34–56 % снизилась частота диабетической нефропатии, оцениваемая по уровню экскреции белка с мочой. Также статистически достоверно снизилась частота клинической нейропатии (на 60 %) и макрососудистых осложнений (на 41 %).
Однако в исследовании ACCORD (2008) не подтвердилось положительное влияние интенсивного гликемического контроля на макрососудистые события [35]. Напротив, интенсивный контроль гликемии увеличивал на 22 % общую смертность, на 35 % — сердечно-сосудистые осложнения и на 10,5 % — развитие гипогликемий, требующих медицинской помощи.
Важным звеном патогенетической терапии у пациентов с СД и КИНК является применение антигипоксанта Актовегина. Он в 5 раз увеличивает внутриклеточный транспорт глюкозы (Obermaier-Kusser B. et al., 1989) и в 3,5 раза — поглощение кислорода клетками (Brott T. et al., 2006) [36, 37].
W. Jansen и E. Beck изучили действие Актовегина на больных с ДПН в рамках контролируемого исследования: одна группа из 35 больных получала плацебо, другая группа из 35 больных — Актовегин в течение 24 недель [38]. Улучшение состояния больных в группе лечения Актовегином отмечено у большинства пациентов через 8 недель после начала лечения, а оптимальный эффект достигался через 16 недель терапии. Показано достоверное улучшение на фоне лечения Актовегином по сравнению с группой плацебо практически всех клинических показателей: расстояния ходьбы без боли, сухожильных рефлексов, поверхностной и глубокой чувствительности (р < 0,01).
Для локального лечения КИНК у больных с сахарным диабетом исключают возможность травмы, проводят лечение диабетической стопы и реваскуляризацию. Лечение диабетической стопы включает концепцию TIME.
— T (Tussue debridment) — удаление мертвых тканей, что уменьшает нагноение и бактериемию. Возможно лечение личинками мух (larwoterapia — lucilif sericata), однако данная терапия противопоказана при глубоких ранах и ранах с покравливанием либо при их близком расположении к большим венам.
— I (Infection and inflammation control) — контроль инфекции и воспаления путем назначения антибактериальной терапии.
— М (Moisture balance) — баланс выделений с помощью ВАК-терапии. ВАК-терапия широко используется в мировой врачебной практике, и ее эффективность подтверждена многочисленными рандомизированными исследованиями. Механизм ее действия заключается в извлечении больших выделений из раны, уменьшении отека и бактериальной флоры, стабилизации среды раны и сближении ее краев. Преимущество ВАК-терапии — в ее адаптации под конкретный клинический случай; низкий уровень противопоказаний, побочных эффектов и осложнений; техническая доступность. При назначении ВАК 10 пациентам у 9 была отмечена позитивная динамика, и лишь у 1 пациента с СД 2-го типа и состоянием после ампутации стопы произошло расширение ишемии, что привело к ампутации на уровне верхней трети голени [39].
— Е (Edges, epidermizion simulation) — изменение краев и стимуляция эпителизации.
Для сохранения конечности показано проведение реваскуляризации во всех случаях, если это технически возможно. К наиболее частым реконструкциям относится аутовенозное бедренно-дистальное шунтирование. Контроль интраоперационной эффективности реконструкции проводится с помощью ультразвукового дуплексного сканирования и ангиографии.
Доктор медицинских наук, профессор кафедры хирургии Ивано-Франковского национального медицинского университета Иван Михайлович Гудз рассказал о синдроме диабетической стопы как мультидисциплинарной проблеме.
Сахарный диабет остается глобальной медицинской проблемой для всего мира. Каждые 17 секунд на планете диагностируют данную патологию, 70 % всех ампутаций приходится именно на пациентов с сахарным диабетом, и такая ампутация совершается каждые 20 секунд [13]. Поэтому предупреждение осложнений СД — актуальная мультидисциплинарная проблема, решение которой должно осуществляться командой специалистов, с участием эндокринолога, общего хирурга, сосудистого хирурга, подолога, психолога и др.
Основные патогенетические звенья заболевания отражены в определении Всемирной организации здравоохранения: диабетическая стопа — это инфекция, язва и/или деструкция глубоких тканей стопы, связанная с неврологическими нарушениями, снижением магистрального кровотока в артериях нижних конечностей различной степени тяжести.
Согласно этому, классификация СДС по клиническим формам с учетом факторов риска включает:
— нейропатическую стопу (преобладают нарушения периферической нервной системы);
— ишемическую (ангиопатическую) стопу (преобладают сосудистые нарушения);
— нейроишемическую стопу (смешанная форма), сочетающую в себе признаки первой и второй формы.
В зависимости от характеристики раны в клинической практике достаточно часто применяют классификации Wagner-Weggitt, PEDIS, Texas Wound Classification System. При ишемии конечности используют классификации Rutherford, Fontaine, при инфекции стопы — IDSA. На сегодняшний день существует новая классификация СДС — WIFI, предложенная I. Joseph, которая применима к больным с СД и без него и покрывает широкий спектр проблем, от критической ишемии без язв до гангрены при СД без ишемии.
Wound — характеристика раны.
Ischemia — степень ишемии.
Foot Infection — состояние инфекционного поражения.
К наиболее частым предикторам возникновения СДС относится диабетическая полинейропатия. Ее патогенез является сложным и многофакторным. Безусловно, ключевая роль в развитии ДПН принадлежит хронической гипергликемии, которая является пусковым механизмом каскада биохимических реакций, приводящих к дегенерации и демиелинизации нервного волокна. В предыдущие годы теории патогенеза ДПН подразделялись на метаболическую и сосудистую. В настоящее время они объединены и рассматриваются как отдельные компоненты одного процесса.
Выделено шесть патофизиологических механизмов ДПН:
1. Активация полиолового пути обмена глюкозы, который приводит к аккумуляции сорбитола и фруктозы, истощению миоинозитола, снижению активности Na+/K+-АТФазы.
2. Нарушение метаболизма жирных кислот и простагландинов, что является причиной повреждения мембран нервных окончаний, микрососудистых и гемореологических нарушений.
3. Эндоневральная ишемия с последующим возникновением гипоксии, образованием свободных радикалов (окислительный стресс), повышением активности протеинкиназы С.
4. Дефицит нейротрофинов, приводящий к пониженной экспрессии и истощению фактора роста нервов, нейротрофина-3, инсулиноподобного фактора роста, а также нарушению аксонального транспорта.
5. Аккумуляция конечных продуктов неферментного гликирования в белковых структурах нервов и сосудов.
6. Иммунологические и воспалительные изменения с наличием антител к различным структурам автономной нервной системы.
Нарушение процессов микроциркуляции — одна из основных причин нейропатии. Изменение обмена жирных кислот (дигомо-д-липоленовой и арахидоновой кислот), изменения в циклооксигеназном цикле приводят к снижению продуцирования вазоактивных субстанций и нарушению эндоневрального кровотока. В свою очередь, развиваются поражение эндоневральных сосудов, гиперплазия эндотелия, утолщение базальной мембраны и реологические нарушения. Как результат — снижается эндоневральный кровоток, поражаются сосуды микроциркуляторного русла, приводящие к гипоксии ткани, ишемии и снижению энергетического метаболизма.
Согласно Национальным рекомендациям [14] терапии диабетической болевой нейропатии, в качестве патогенетического лечения назначаются альфа-липоевая кислота и Актовегин. Альфа-липоевая кислота назначается в дозе 600 мг в день внутривенно (в/в) № 10–15 с дальнейшим приемом пероральных лекарственных форм до 2 месяцев. Курс проводят 2–3 раза в год. Также в качестве патогенетического лечения назначается Актовегин до 2 г в день в/в № 10 с дальнейшим приемом пероральных лекарственных форм до 2 месяцев. Курс проводят до 2–3 раз в год.
Эффективность влияния Актовегина на артериальное кровоснабжение у больных с макроангиопатией была показана в исследовании H. Moerl et al. [16]. В группе пациентов, получающих Актовегин, увеличилась дистанция безболевой ходьбы на 49 против 23 % в группе плацебо, а увеличение дистанции максимальной ходьбы на 59 % значительно превосходило плацебо (17 %).
Результаты другого рандомизированного плацебо-контролируемого исследования, проведенного S. Horsch et al., также продемонстрировали преимущество Актовегина [17]. Под влиянием инфузий 20% раствора Актовегина отмечалось нарастание дистанции безболевой ходьбы на 58 %, дистанции максимальной ходьбы — на 53 %, тогда как в группе плацебо эти показатели составили 34 и 44 % соответственно.
В крупном международном многоцентровом плацебо-контролируемом исследовании, включавшем 567 пациентов с СД 2-го типа, имевших симптомы полинейропатии, было показано, что курс лечения Актовегином в течение 160 дней приводит к достоверному уменьшению выраженности субъективных и объективных симптомов полинейропатии по отношению как к исходному уровню, так и к плацебо.
Курс лечения Актовегином включал внутривенные инфузии по 2 г в сутки (раствор 20% Актовегина в 250 мл физиологического раствора) в течение 20 дней с последующим переходом на прием внутрь по 600 мг (3 таблетки по 200 мг) 3 раза в день. На фоне лечения отмечено снижение порога вибрационной чувствительности, что может в перспективе снижать риск развития трофических язв стопы.
Результаты данного исследования послужили основанием для включения Актовегина в схему лечения пациентов с ДПН, предложенную в докладе-лекции профессора Dan Ziegler (Дюссельдорф, Германия) на 46-м конгрессе Европейской ассоциации по изучению диабета (EASD), который состоялся в г. Стогкольме (Швеция) 20–24 сентября 2010 г.
В докладе Dan Ziegler предложил схемы лечения ДПН, основанные на принципах доказательной медицины, с учетом данных проведенных многоцентровых клинических исследований. Была показана достоверная эффективность препаратов альфа-липоевой кислоты и Актовегина в качестве патогенетической терапии диабетической нейропатии, что объективизировалось достоверным улучшением оценки по шкалам TSS и NISS-LL. При этом следует отметить, что только Актовегин показал достоверное улучшение показателя вибрационной чувствительности (по данным VPT), что является индикатором развития диабетической стопы.
Во всех проведенных исследованиях Актовегин по безопасности был сопоставим с плацебо. Положительное действие Актовегина при диабетической нейропатии может быть связано как с улучшением энергетического метаболизма нервных волокон, так и с противодействием их гипоксии и ишемии, что особенно важно, учитывая важную роль в развитии диабетической нейропатии не только метаболических нарушений, но и снижения эндоневрального кровотока и ишемии нервов. Актовегин обладает выраженной антиоксидантной активностью. В клетках Актовегин активно участвует в каскадах ферментативных метаболических реакций, уменьшая проявления окислительного стресса и способствуя регенерации тканей [18]. Вазотропное действие Актовегина реализуется за счет активации капиллярного кровотока, улучшения метаболизма и энергообмена в эндотелии сосудов [19]. Нормализация эндотелиальной функции сопровождается высвобождением эндогенных вазодилататоров — простациклина и оксида азота, уровень которых у больных СД значительно снижен, в результате чего улучшается перфузия органов и тканей и снижается периферическое сосудистое сопротивление.
ACTO-PUB-052015-115
Список литературы находится в редакции