Международный эндокринологический журнал 3 (67) 2015
Вернуться к номеру
Інсулінотерапія при цукровому діабеті 2-го типу: необхідність раннього старту та можливості вибору
Авторы: Головач І.Ю., Дячек О.В. - Клінічна лікарня «Феофанія» Державного управління справами, м. Київ
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Досягнення цільових значень глікемічного профілю — основна мета терапії цукрового діабету (ЦД) 2-го типу. Раннє призначення інсуліну дозволяє не тільки швидко й ефективно знизити показники глікемії й компенсувати вуглеводний обмін, а й зменшити ризик розвитку серцево-судинних ускладнень. Раннє й обґрунтоване використання інсуліну, своєчасна титрація його дози — визначальні фактори досягнення цільових рівнів глікемії у хворих на ЦД 2-го типу, що відкривають широкі можливості досягнення основних цілей лікування ЦД — підтримання довгострокового метаболічного контролю і запобігання
судинним ускладненням або відстрочення їх розвитку.
Достижение целевых значений гликемического профиля — основная цель терапии сахарного диабета (СД) 2-го типа. Раннее назначение инсулина позволяет не только быстро и эффективно снизить показатели гликемии и компенсировать углеводный обмен, но и уменьшить риск развития сердечно-сосудистых осложнений. Раннее и обоснованное назначение инсулина, своевременная титрация его дозы — решающие факторы достижения целевых уровней гликемии у больных СД 2-го типа, которые открывают широкие возможности достижения основных целей лечения СД — поддержания долгосрочного метаболического контроля и предотвращения сосудистых осложнений или отсрочки их развития.
Achieving target values of glycemic profile — the main objective of therapy for type 2 diabetes mellitus (DM2). Early administration of insulin enables not only to lower glycemic parameters quickly and effectively and to compensate carbohydrate metabolism, but also to reduce the risk of cardiovascular complications. Early and reasonable administration of insulin, timely titration of its dose — determinants of achieving target blood glucose levels in patients with DM2, and provide numerous opportunities to achieve the main goals of DM treatment — maintenance of long-term metabolic control and prevention or delay of vascular complications.
цукровий діабет 2-го типу, контроль глікемії, інсулінотерапія.
сахарный диабет 2-го типа, контроль гликемии, инсулинотерапия.
type 2 diabetes mellitus, glycemic control, insulin therapy.
Статья опубликована на с. 107-111
Безпрецедентні темпи поширення цукрового діабету (ЦД) у світі стають однією з проблем охорони здоров’я та обтяжують рівною мірою як розвинені, так і країни, що розвиваються. Крім того, сьогодні ми спостерігаємо зростання числа випадків ЦД 2-го типу у дітей та підлітків, що в майбутньому може призвести до формування такого катастрофічного тягаря хвороби, як судинні ускладнення, а це, у свою чергу, негативно позначиться і на молодій популяції [3].
ЦД 2-го типу — хронічне невиліковне прогресуюче захворювання, перебіг якого ускладнюється не тільки розвитком специфічних мікро- і макросудинних ускладнень, що суттєво інвалідизують пацієнтів і призводять до зростання серцево-судинної летальності, але й прогресуванням інсулінової недостатності на тлі зростаючої інсулінорезистентності, внаслідок чого відбувається неминуче зниження дієвості цукрознижувальної терапії, що проводиться. Причиною цих змін у перебігу захворювання є гіперглікемія і викликаний нею феномен глюкозотоксичності, що призводить до пошкодження фосфоліпідного шару плазматичних мембран тканин-мішеней і бета-клітин, сприяючи прогресуванню інсулінорезистентності і зниженню секреторних можливостей інсулярного апарату за рахунок апоптозу бета-клітин. За статистичними показниками, щорічно від 5 до 10 % хворих на ЦД 2-го типу потребують переведення на інсулінотерапію задля здійснення адекватного глікемічного контролю [6]. Отже, причиною розвитку і прогресування ускладнень захворювання є саме хронічна гіперглікемія, тому жорсткий контроль глікемії є зараз основою профілактики розвитку та прогресування судинних ускладнень ЦД [18].
У даний час ЦД 2-го типу розглядається як захворювання, що виникає в результаті подвійного дефекту — зниження чутливості периферичних тканин до інсуліну та порушення його продукції. Дуже важливо відзначити, що ЦД 2-го типу є хронічним, безперервно прогресуючим захворюванням, оскільки з часом відбувається поступове погіршення продукції інсуліну бета-клітинами підшлункової залози, погіршуються показники глікемії, виникає необхідність у більш інтенсивній цукрознижувальній терапії [5].
Незважаючи на існування безлічі передових принципів роботи й інформаційної підтримки, у цілому контроль глікемії досягається в значно меншій кількості випадків, ніж ми очікуємо. Певною мірою такі незадовільні результати можна пояснити постійно прогресуючою дисфункцією бета-клітин, у зв’язку з чим у багатьох пацієнтів із ЦД 2-го типу лікування пероральними цукрознижувальними препаратами не дозволяє досягти або підтримувати адекватний рівень глікемії. На жаль, у багатьох із цих випадків гіпоглікемічна терапія не коригується, що зумовлює тривалу гіперглікемію та підвищення ризику розвитку ускладнень. Термін «клінічна інертність» виник для позначення відсутності призначення або інтенсифікації терапії за наявності клінічних показань. Найяскравіше це проявляється у випадку призначення інсуліну [1]. Таким чином, для покращання результатів лікування і зменшення ризику виникнення ускладнень захворювання більш активне управління глікемією є виправданим (зокрема, можливість більш раннього застосування інсуліну, ніж це прийнято сьогодні).
Отже, зі зростанням тривалості ЦД 2-го типу даною недугою все важче керувати, тому для досягнення і підтримання цільових показників глікемії виникає потреба в інсуліні. Цей проміжок часу чітко визначений у дослідженні United Kingdom Prospective Diabetes Study (UKPDS), де було продемонстровано, що через 6 років після встановлення діагнозу діабету половина пацієнтів із ЦД 2-го типу потребувала призначення інсуліну, а згодом (через 10–12 років) уже близько 80 % пацієнтів потребують постійної інсулінотерапії [20]. Отже, дослідження UKPDS виявило прогресуюче зниження функції β-клітин при ЦД 2-го типу і потребу в інсулінотерапії для більшості пацієнтів. Раннє призначення інсулінотерапії може сприяти досягненню та підтриманню глікемічного контролю в разі неефективності пероральних цукрознижувальних препаратів (ПЦЗП), знижуючи тим самим ризик розвитку ускладнень ЦД [7].
Загальновизнано, що успіх будь-якої терапії неінсуліновими засобами залежить від залишкової функції β-клітин [13, 17]. При діагностиці ЦД секреція інсуліну в середньому знижується наполовину. У подальшому функція бета-клітин погіршується зі швидкістю приблизно 4–6 % щорічно, що зумовлює необхідність вибору оптимальної терапії на кожному етапі розвитку захворювання [19]. Зменшення глюкозотоксичності на ранніх стадіях недуги потенційно дозволяє зберегти функціональну активність β-клітин.
Рішення почати інсулінотерапію у хворих на ЦД 2-го типу є непростим. У зв’язку з цим можна згадати думку експертів Європейської групи з формування політики в галузі ЦД 2-го типу, що лікування інсуліном має розпочинатися не надто рано і не занадто пізно. Не надто рано, тому що дефіцит секреції інсуліну може бути вторинним щодо інсулінорезистентності і у зв’язку з підвищенням ризику розвитку гіпоглікемій, а також збільшення маси тіла і, нарешті, розвитку хронічної периферичної гіперглікемії. Не надто пізно — для того щоб мати можливість домогтися оптимального глікемічного контролю [1, 5].
Сучасні керівництва рекомендують дотримуватися принципу покрокової терапії хворих на ЦД 2-го типу. Спочатку ми повинні пояснити пацієнтові, наскільки важливо нормалізувати масу тіла, фізичну активність і дотримуватися дієти. Якщо модифікації способу життя недостатньо для контролю глікемії, необхідно призначити препарат першої лінії — метформін. За наявності протипоказань до прийому метформіну застосовуються препарати сульфонілсечовини. У зв’язку з пізнім виявленням ЦД 2-го типу та значною втратою функції β-клітин до моменту маніфестації захворювання монотерапія досить часто не має належного ефекту. У такій ситуації необхідно негайно переходити на комбіноване лікування, що включає прийом препаратів, які поліпшують чутливість тканин до інсуліну (метформін) і його секрецію (похідні сульфонілсечовини). Призначення базального інсуліну є найбільш ефективним у пацієнтів із HbA1c > 8,5 % [5].
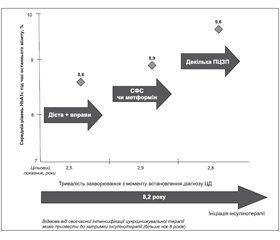
На підставі результатів клінічних випробувань, що довели ефективність інсулінотерапії в досягненні цільового рівня глікованого гемоглобіну (HbA1c), тепер створені достатньо чіткі алгоритми, що визначають показання для початку інсулінотерапії в пацієнтів із ЦД 2-го типу залежно від початкового рівня HbA1c (рис. 1).
Показанням для призначення інсулінотерапії у пацієнтів з уперше виявленим ЦД 2-го типу слугує початковий рівень HbA1c > 8,5–9 % або ж неможливість досягнення цільового для даного пацієнта рівня HbA1c на максимальних дозах комбінації двох чи трьох ПЦЗП [2, 6]. Своєчасний початок інсулінотерапії при вперше виявленому ЦД дозволяє швидко й ефективно досягти цільового рівня компенсації вуглеводного обміну і, на думку експертів Американської діабетичної асоціації і Європейської асоціації з вивчення діабету, у деяких випадках перевести пацієнта в подальшому на пероральну цукрознижуючу терапію через зняття феномену глюкозотоксичності й відновлення таким чином секреторної активності інсулярного апарату [16].
На жаль, у реальній клінічній практиці спостерігаються неприйнятні затримки у змінах терапії пацієнтів, що постає однією з причин високого ризику ускладнень ЦД 2-го типу, а також незадовільної компенсації вуглеводного обміну навіть на тлі інсулінотерапії [14]. Старт інсулінотерапії доцільно розпочинати з базального режиму [2, 4, 7, 15].
Переваги своєчасного старту інсулінотерапії при ЦД 2-го типу з базального режиму:
— сприяє збереженню ендогенної секреції інсуліну;
— дозволяє легко й безпечно додавати інсулін до базової терапії пероральними цукрознижувальними препаратами;
— нормалізує рівень глюкози натще і покращує контроль постпрандіальної глікемії при пероральній цукрознижувальній терапії;
— дозволяє зменшити добову дозу інсуліну і запобігає збільшенню маси тіла.
Основною метою інсулінотерапії в пацієнтів із ЦД 2-го типу є корекція інсулінодефіциту шляхом моделювання нормальної секреції інсуліну β-клітинами підшлункової залози, уникаючи гіпер- або гіпоглікемії. Зрозуміло, що успіх призначеної інсулінотерапії залежить від того, наскільки близько ми можемо відтворити власну фізіологічну секрецію під час їжі для контролю постпрандіальної глікемії і базальну секрецію для контролю глікемії натще, а також глікемії між прийомами їжі [1, 2].
Початок інсулінотерапії із застосування базального інсуліну на додаток до пероральної цукрознижувальної терапії у пацієнта з ЦД 2-го типу досягається шляхом однієї щоденної ін’єкції, що, безумовно, дозволяє перебороти страх пацієнта перед початком використання інсуліну. Призначення базального інсуліну у вечірній час має чітке патофізіологічне підґрунтя, оскільки здебільшого в пацієнтів із ЦД 2-го типу в нічні години відбувається надмірна печінково-опосередкована продукція глюкози. Введення базального інсуліну перед сном (чи ввечері) перешкоджає нічному підвищенню глікемії, дозволяє нормалізувати рівень глюкози натще, а також контролювати глюкозотоксичність. Своєчасна оптимізація метаболічного контролю має величезне значення у контексті можливості зниження частоти хронічних захворювань. Так, чітко встановлений зв’язок між постпрандіальною гіперглікемією і розвитком серцево-судинних захворювань. При рівні показника, що перевищував 6,1 ммоль/л, ризик розвитку серцево-судинних подій у наступні 12,4 року збільшувався в 1,33 раза [9]. Отримані докази того, що ізольована постпрандіальна гіперглікемія є незалежним фактором ризику макросудинних ускладнень. За даними одного з метааналізів, постпрандіальна гіперглікемія > 7,8 ммоль/л на тлі глікемії натще < 6,0 ммоль/л та рівня HbA1c < 6,1 % була пов’язана з дворазовим збільшенням серцево-судинної смертності [7].
Стартова доза інсуліну в пацієнтів із ЦД 2-го типу, які не отримували інсулін, становить 10 МО або 0,1–0,2 МО/кг маси тіла на добу. Надалі дозу слід титрувати залежно від середніх показників глюкози крові натще з підвищенням дози до досягнення індивідуального цільового рівня.
Проведені дослідження з ініціації інсулінотерапії підтвердили простоту й ефективність самостійної титрації дози базального інсуліну при щоденному самоконтролі глікемії натще [11, 21]. Найбільш простим і ефективним є алгоритм титрації дози інсуліну кожні 3 дні, до досягнення цільових значень HbA1c. Титрація дози здійснюється за середнім рівнем глікемії натще за 3 попередніх дні. За відсутності протипоказань рівень глюкози плазми натще не повинен перевищувати 6,5 ммоль/л [3].
У низці інших досліджень — INITIATE [20], ATLANTUS [10], TREAT-TO-TARGET — був запропонований алгоритм щотижневої титрації, який був також ефективним і сприяв меншому підвищенню маси тіла.
Водночас, за даними дослідження Diabetes Control and Complications Trial (DECODE) [12], саме постпрандіальна глікемія підвищує ризик прогресування серцево-судинних ускладнень, які є, як відомо, основною причиною підвищення летальності при ЦД 2-го типу. Сучасні алгоритми інтенсифікації інсулінотерапії при ЦД 2-го типу припускають додавання прандіального інсуліну до базальної інсулінотерапії в таких ситуаціях:
— глікемія натще близька до мети або на цільовому рівні, але HbА1с вищий за цільовий рівень;
— глікемія натще під контролем, але постпрандіальна глікемія постійно вища від цільових показників;
— у період титрації дози базального інсуліну відзначаються неприйнятно часті або тяжкі гіпоглікемії.
Прогресування інсулінової недостатності при ЦД 2-го типу вимагає послідовного застосування додаткових ін’єкцій прандіального інсуліну не тільки перед основним прийомом їжі, але й перед другим, і третім прийомом, виходячи з рівня препрандіальної глікемії з титрацією його дози за рівнем постпрандіальної глікемії. Сучасні рекомендації орієнтують лікарів на такі цільові рівні пре- і постпрандіальної глікемії при ЦД 2-го типу (табл. 1).
Зараз для пацієнтів, які не потребують або не готові до використання інтенсивних режимів інсулінотерапії, реальною альтернативою є використання готових сумішей, що забезпечують зручний, ефективний і безпечний режим інсулінотерапії. Вважається, що інсулінові суміші зручні в застосуванні у літніх пацієнтів із рівнем HbA1c > 8,5 ммоль/л, не здатних з огляду на можливі когнітивні відхилення до інтенсивного режиму базисно-болюсної терапії.
Використання готових сумішей інсуліну в різних країнах доволі відрізняється: від понад 60 % всіх використовуваних інсулінів в Німеччині до 20–30 % у Канаді та США [8]. У більшості країн відзначається стійка тенденція до збільшення використання саме змішаних інсулінів. Готові суміші дозволяють максимально індивідуалізувати лікування. Крім того, дані сучасних зарубіжних і вітчизняних досліджень свідчать, що готові суміші на основі аналогів людського інсуліну, що складаються з ультракороткого і продовженого інсулінів, забезпечують такий же контроль глікемії, як і при використанні більш інтенсивних режимів інсулінотерапії у пацієнтів із ЦД 2-го типу.
Використання готової суміші в пропорції 30 : 70, введеної за допомогою щприц-ручки, доцільне для літніх пацієнтів із ЦД 2-го типу. Такий інсулін має переваги перед базисним інсуліном, оскільки лікування тільки базальним інсуліном за відсутності короткого недостатнє для ефективного контролю глікемії після прийому їжі. Терапія готовими сумішами в пропорції 30 : 70 розпочинається з добової дози 0,4–0,6 ОД/кг маси тіла, зазвичай розділеної порівну на дві ін’єкції — перед сніданком і вечерею; у частини пацієнтів 2/3 добової дози призначається перед сніданком і 1/3 — перед вечерею. Далі доза інсуліну за необхідності поступово збільшується кожні 2–4 дні на 4–6 ОД, до досягнення цільових рівнів контролю.
Варто зауважити, що в деяких пацієнтів готові суміші можуть підтримувати належний глікемічний контроль протягом тривалого періоду захворювання [4]. Отже, змішані інсуліни на основі аналогів людського інсуліну зручні в застосуванні щодо прийому їжі та кількості ін’єкцій, що підвищує якість життя пацієнтів, а також забезпечують імітацію фізіологічної секреції інсуліну [1].
Підбиваючи підсумки, слід зазначити, що з часу відкриття інсуліну Ф. Бантінгом і Ч. Бестом минуло майже століття, але інсулін, як і раніше, залишається найдієвішим цукрознижувальним засобом. Все ще необхідні значні зусилля для підвищення ефективності глікемічного контролю в пацієнтів із ЦД 2-го типу. Раннє й обґрунтоване призначення інсулінотерапії, своєчасна титрація дози роблять незамінний внесок в успішне лікування захворювання, дозволяють максимально оптимізувати лікувальний процес, підвищити комплайєнтність і якість життя пацієнтів, які страждають від цієї тяжкої недуги.
1. Аметов А.С. Инсулинотерапия. Роль и место в управлении CД 2-го типа // РМЖ. — 2014. — Т. 22, № 13. — С. 970–973.
2. Полторак В.В., Горшунська М.Ю., Красова Н.С. Адипонектин та цукровий діабет 2-го типу (патогенетичні аспекти як підґрунтя для оптимізації антидіабетичної фармакотерапії) [Текст] / В.В. Полторак // Международный эндокринологический журнал. — 2014. — № 5(61). — С. 95–104.
3. Дедов И.И., Шестакова М.В. Оптимизация и интенсификация инсулинотерапии при сахарном диабете 2 типа (клинические рекомендации) // Сахарный диабет (спецвыпуск). — 2010. — С. 9–16.
4. Паньків В.І. Цукровий діабет 2 типу: як уникнути помилок і підвищити ефективність лікування / В.І. Паньків // Міжнародний ендокринологічний журнал. — 2014. — № 4(52). — С. 79–84.
5. Маньковский Б.Н. Инсулинотерапия при сахарном диабете 2 типа: важно не упустить время // Здоровье Украины. — 2008. — № 8/1. — С. 13.
6. Недосугова Л.В. Инсулинотерапия при сахарном диабете 2-го типа: когда, как и чем начинать? // Consilium Medicum. — 2013. — № 4. — С. 42–48.
7. Ткаченко В.І. Аналіз медичного стану пацієнтів з цукровим діабетом 2-го типу та його вплив на розвиток ускладнень / В.І. Ткаченко, Б.М. Маньковський, М.М. Долженко // Міжнародний ендокринологічний журнал. — 2014. — № 8. — С. 18–23.
8. Шамхалова М.Ш., Чугунова Л.А., Шестакова М.В. Цели и задачи нсулинотерапии при сахарном диабете типа 2: место готовых инсулиновых смесей // Consilium Medicum. — 2003. — Т. 5, № 9. — С. 491–494.
9. Coutinho M., Gerstein H., Wang Y., Yusuf S. The relationship between glucose and incident cardiovascular events. A metaregression analysis of published data from 20 studies of 95,783 individuals followed for 12,4 years // Diabetes Care. — 1999. — Vol. 22(2). — P. 233–240.
10. Dailey G. Optimum management of type 2 diabetes-timely introduction, optimization and intensification of basal insulin // Diabetes Obes. Metab. — 2008. — Vol. 10 (Suppl. 2). — P. 5–13.
11. Davies M., Lavalle-Gonzalez F., Storms F., Gomis R. Initiation of insulin glargine therapy in type 2 diabetes subjects suboptimally controlled on oral antidiabeticagents: results from the ATLANTUS trial // Diabetes Obes. Metab. — 2008. — Vol. 10. — P. 387–399.
12. Decode Study Group. Glucose tolerance and mortality: comparison of WHO and American Diabetes Association diagnostic criteria // Lancet. — 1999. — Vol. 354. — P. 617–621.
13. DeWitt D.E., Hirsch I.B. Outpatient insulin therapy in type 1 and type 2 diabetes mellitus: scientific review // JAMA. — 2003. — Vol. 289(17). — P. 2254–2264.
14. Evans M.L., Sharplin P., Owens D.R. et al. Insulin usage in type 2 diabetes mellitus patients in UK cinical practice: a retrospective cohort-based analysis using THIN database // Br. J. Diabetes & Vasc. Dis. — 2010. — Vol. 10(4). — P. 178–182.
15. Joshi S., Joshi P. A review of insulin and insulin regimes in type 2 diabetes SA // Fam. Pract. — 200. — Vol. 51(2). — P. 97–102.
16. Nathan D.M., Buse J.B., Davison M.B. et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and European Association for the Study of Diabetes // Diabetes Care. — 2009. — Vol. 32. — P. 193–203.
17. Neumiller J.J., Odegard P.S., Wysham C.H. Update on insulin management in type 2 diabetes // Diabetes Spectrum. — 2009. — Vol. 22. — P. 85–91.
18. Niskanen L., Turpeinen A., Penttila I., Uusitupa M.I. Hyperglycemia and compositional lipoprotein abnormalities as predictors of cardiovascular mortality in type 2 diabetes: a 15-year follow-up from the time of diagnosis // Diabetes Care. — 1998. — Vol. 21(11). — P. 1861–1869.
19. Shim W.S., Kim S.K., Kim H.J. et al. Decrement of postprandial insulin secretion determines the progressive nature of type-2 diabetes // Eur. J. Endocrinol. — 2006. — Vol. 155(4). — P. 615–622.
20. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas os insulin compared with conventional treatment and risk os complications in patients with type 2 diabetes (UKPDS 33) // Lancet. — 1998. — Vol. 352. — P. 837–853.
21. Yki-Jarvinen H. et al. Initiate Insulin by Aggressive Titration and Education (INITIATE) // Diabetes Care. — 2007. — Vol. 30. — P. 1364–1369.

/109/109.jpg)
/110/110.jpg)