Международный эндокринологический журнал 3 (67) 2015
Вернуться к номеру
Артериальные гипертензии надпочечникового генеза: аспекты лабораторного обследования
Авторы: Луценко Л.А. — Киевский городской клинический эндокринологический центр
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Необходимость правильного выбора тактики ведения пациента с артериальной гипертензией обусловлена возможным развитием сердечной недостаточности и сердечно-сосудистых осложнений. Исключение патологии надпочечных желез — один из важных этапов выявления причины вторичной гипертензии, когда основная роль принадлежит методам лабораторной диагностики.
Необхідність правильного вибору тактики ведення пацієнта з артеріальною гіпертензією обумовлена можливим розвитком серцевої недостатності та серцево-судинних ускладнень. Виключення патології надниркових залоз — один із важливих етапів виявлення причини вторинної гіпертензії, коли основна роль належить методам лабораторної діагностики.
The need for a correct choice of managing patients with hypertension is due to the possible development of heart failure and cardiovascular complications. Excluding adrenal pathology is one of the important steps in diagnosing the cause of secondary hypertension, when the main role belongs to the methods of laboratory diagnostics.
артериальная гипертензия, надпочечные железы, кортизол, альдостерон, ренин, метанефрины.
артеріальна гіпертензія, надниркові залози, кортизол, альдостерон, ренін, метанефрини.
hypertension, adrenal glands, cortisol, aldosterone, renin, metanephrines.
Статья опубликована на с. 117-121
Распространенность артериальной гипертензии (АГ) в общей популяции находится в диапазоне 30–45 % [1]. Актуальной является диагностика причин вторичной АГ, на которую могут указывать резко выраженное повышение артериального давления (АД), внезапное начало или ухудшение течения АГ, лимитированная эффективность медикаментозного лечения, поражение органов-мишеней, не соответствующее длительности АГ. Считается, что для эффективного ведения пациентов с данной патологией необходим мультидисциплинарный подход, то есть участие специалистов разных областей, в том числе и эндокринолога. Выявление эндокринной патологии, и в частности патологии надпочечных желез, кардинально влияет на выбор тактики ведения данных пациентов.
По мировым данным, у каждого десятого больного АГ диагностируют патологию надпочечных желез. АГ надпочечникового генеза может быть следствием первичного гиперальдостеронизма, катехоламинпродуцирующей опухоли, синдрома Кушинга.
Синдром АГ является классическим клиническим проявлением первичного гиперальдостеронизма [2–4]. Менее чем у 4 % пациентов с первичным гиперальдостеронизмом АД находится в пределах нормы [5]. Частота злокачественной гипертензии составляет 6–9 %, гипертензии с кризовым течением — 50 % [6]. Другие синдромы встречаются значительно реже. Нейромышечный синдром, включающий мышечную слабость, судороги, парестезии, встречается в 38–75 %, почечный синдром, сопровождающийся полиурией, полидипсией, никтурией, — в 50–70 % [7, 8].
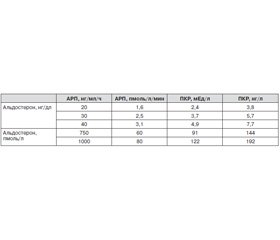
Классические лабораторные признаки первичного гиперальдостеронизма составляют известную триаду: гипокалиемия, повышение концентрации альдостерона плазмы, снижение активности ренина. Длительное время считалось, что уровень калия выше 3,5 ммоль/л исключает диагноз первичного гиперальдостеронизма [4, 9, 10]. В настоящее время считается, что сочетание АГ и гипокалиемии характерно только для наиболее тяжелых форм гиперальдостеронизма, при которых произошли необратимые изменения в почках и сердечно-сосудистой системе [4, 11, 12]. Так, по данным литературы, частота нормокалиемического варианта первичного гиперальдостеронизма может достигать 75–80 % [6–8]. Самостоятельное определение уровней калия или альдостерона имеет низкую чувствительность, ренина — низкую специфичность [13]. Наиболее информативным лабораторным показателем для диагностики первичного гиперальдостеронизма считается альдостерон-рениновое соотношение (АРС) [3, 8, 13]. Основным недостатком данного теста можно считать отсутствие стандартизации [14]. Диагностическое значение АРС зависит от метода исследования и единиц измерения альдостерона и ренина и представлено в табл. 1 [13].
Возможные ложноположительные и ложноотрицательные результаты могут быть связаны с сопутствующими заболеваниями (нефропатией, стенозом почечных артерий различного генеза) или приемом лекарственных препаратов (ингибиторы АПФ, диуретики, блокаторы ангиотензиновых рецепторов и др.). Иногда для диагностики первичного гиперальдостеронизма используют функциональные и нагрузочные пробы (проба с пероральной натриевой нагрузкой, тест с физиологическим раствором хлорида натрия, супрессивный тест с флудрокортизоном (кортинеффом), тест с каптоприлом) [8, 13, 15]. Золотой стандарт в дифференциальной диагностике первичного гиперальдостеронизма — селективный забор крови из центральных вен надпочечных желез и нижней полой вены с определением уровня альдостерона и кортизола [6, 7, 12, 16]. Но, несмотря на высокую чувствительность (90–95 %) и специфичность (87–100 %), данная методика используется редко ввиду технической сложности процедуры [6, 7, 12, 17].
Таким образом, с целью исключения гиперпродукции альдостерона при АГ определяют АРС [6, 12, 13, 18], которое обладает высокой чувствительностью (90 %) и специфичностью (91 %) для выявления нарушений в ренин-ангиотензин-альдостероновой системе [6, 12, 13, 18, 19].
Важными факторами, которые влияют на результаты АРС, являются четкое соблюдение правил подготовки пациента и условий забора крови. Забор крови осуществляется в утренние часы (до 10 часов утра), после пребывания пациента в вертикальном положении в течение двух часов, а затем нахождения в сидячей позе в течение 5–15 мин. Обязательное условие подготовки пациента к определению АРС — определение уровня калия в плазме и затем, при необходимости, коррекция. В течение 2–3 дней перед исследованием не рекомендуется ограничивать потребление натрия. Не менее чем за 4 недели отменяются препараты, влияющие на показатели АРС: селективные ингибиторы альдостерона (эплеренон), диуретики, продукты из корня лакрицы (солодки). За две недели до исследования необходимо отменить бета-адреноблокаторы, центральные aльфа-адреномиметики (клонидин, aльфа-метилдопа), нестероидные противовоспалительные препараты, ингибиторы АПФ, блокаторы ангиотензиновых рецепторов, ингибиторы ренина, дигидропиридиновые блокаторы кальциевых каналов. При интерпретации результатов исследования крови обязательно учитывают факторы, которые могут влиять на уровень альдостерона, ренина, АРС.
Следующей нозологией, клиническим проявлением которой может быть АГ, является феохромоцитома (ФХЦ). Клиническая картина катехоламинпродуцирующих опухолей характеризуется разнообразностью и непостоянством проявлений. Среди клинических симптомов наиболее часто (85–95 % случаев) встречаются АГ и симптомы поражения сердечно-сосудистой системы [2, 20, 21]. Постоянная форма гипертензии при ФХЦ встречается в 10–60 % случаев [6, 21], пароксизмальная — в 42–87 % [6]. Для постоянной формы характерно частое возникновение кризов с повышением АД до 280/160 мм рт.ст. Пароксизмы продолжаются от нескольких минут до нескольких часов с частотой от одного раза в месяц до нескольких раз в день [21–23]. Повышение АД сопровождается сильной головной болью, профузным потоотделением, тремором, сердцебиением, чувством тревоги. Для подтверждения диагноза ФХЦ необходимо лабораторное обследование пациента. Наиболее эффективно определение уровня плазменных или мочевых метанефринов, отражающих опухолевую активность ФХЦ на протяжении суток [21, 24, 25]. При ФХЦ метанефрины синтезируются непосредственно в опухоли, а затем экскретируются в кровь. Наиболее высокой чувствительностью (98 %) обладает метод определения метанефринов в плазме [18, 19]. Чувствительность и специфичность определения фракционированных метанефринов мочи ниже [26]. Незначительное повышение уровня метанефринов связано с незначительной вероятностью ФХЦ, в то же время повышение уровня метанефринов в 4 раза и больше ассоциируется почти со 100% вероятностью катехоламинпродуцирующей опухоли [27]. При этом исследователи указывают на возможность ложноположительных результатов при заборе крови в положении сидя или приеме медикаментозных препаратов (трициклические антидепрессанты, метилдопа, симпатомиметики, ацетаминофен и др.). Актуальным лабораторным тестом является определение в плазме крови 3-метокситирамина, который может быть маркером злокачественности ФХЦ.
Причиной АГ, связанной с надпочечными железами, кроме гиперальдостеронизма и катехоламинпродуцирующих опухолей, может быть синдром Кушинга, при котором у 85 % больных встречается синдром АГ, часто сопровождающийся развитием недостаточности кровообращения и сердечно-сосудистыми осложнениями. Ранними проявлениями синдрома Кушинга являются нарушения половой функции в виде нарушения менструального цикла, вплоть до аменореи и бесплодия, снижение либидо, гирсутизм у женщин и снижение потенции у мужчин. Для больных с синдромом Кушинга характерно выраженное диспластическое ожирение с преимущественным отложением жира в области плечевого пояса, передней брюшной стенки, лица; истончение конечностей за счет проксимальных амиотрофий. Кожа сухая, тонкая, со сниженным тургором, множественные широкие синюшно-багровые стрии. Характерно развитие остеопороза, нарушения углеводного обмена (от преходящей гипергликемии до стероидного диабета).
Для диагностики синдрома Кушинга огромное значение имеет выбор метода лабораторной диагностики. При этом необходимо учитывать, что большая часть кортизола связана с белками (кортизолсвязывающий глобулин, транскортин, альбумин), свободный кортизол (активная фракция) составляет 1–2 %. Кортизол подвержен суточным ритмам: в норме — максимальный уровень утром, минимальный — ночью. У пациентов с синдромом Кушинга циркадный ритм нарушен: содержание кортизола в плазме крови утром (9:00) в большинстве случаев остается нормальным, а ночью повышается.
Согласно международным рекомендациям The diagnosis of Cushing’s syndrome: an Endocrine Society clinical practice guideline 2008 года, скрининговыми тестами для диагностики синдрома Кушинга являются: дексаметазоновый (1 мг) супрессивный тест, определение суточной экскреции кортизола с мочой, ночное определение кортизола в слюне.
В основе ночного супрессивного теста с 1 мг дексаметазона лежит подавление секреции АКТГ с последующим снижением продукции кортизола. Для проведения данного исследования не требуется предварительной подготовки пациента, и возможно амбулаторное проведение теста. Методика проведения следующая: пациент принимает 1 мг дексаметазона в 23:00, в 8–9 часов следующего утра осуществляется забор крови для исследования уровня кортизола. При уровне кортизола крови > 1,8 мкг/дл (50 нмоль/л) диагноз гиперкортицизма подтверждается. Преимущества данной пробы — отсутствие потребности в предварительной подготовке пациента и возможность амбулаторного обследования при условии комплайентности пациента [6]. Чувствительность и специфичность дексаметазоновой (1 мг) супрессивной пробы зависят от выбора нижней границы супрессии кортизола. Так, при снижении уровня кортизола сыворотки крови менее 5 мкг/дл (140 нмоль/л) специфичность пробы составляет 100 %, а чувствительность — 58 %, а при нижней границе нормы 1,8 мкг/дл (50 нмоль/л) — 75–100 % и 72–82 % соответственно [18].
Определение кортизола в суточной моче также обладает достаточно высокой чувствительностью и специфичностью. При этом необходимо двукратное исследование свободного кортизола в моче, поскольку у 9 % пациентов с гиперкортицизмом как минимум один результат может оставаться в пределах нормы.
Наиболее ценным тестом для выявления гиперкортицизма является вечернее определение кортизола в слюне, которое отражает концентрацию свободного (биологически активного) кортизола, а также исключает влияние на результат циркадного ритма кортизола. Содержание кортизола в слюне не зависит от ее объема и остается стабильным до семи дней даже при комнатной температуре. К преимуществам определения кортизола слюны можно отнести: отсутствие необходимости госпитализации и участия среднего медперсонала, нет фармакологического вмешательства, безболезненность и неинвазивность методики. Правила сбора образцов следующие: в течение 30 мин до сбора слюны не принимать пищу, не курить, не чистить зубы и не употреблять напитки, за сутки исключить употребление спиртных напитков, избегать образцов, контаминированных кровью (даже слегка красные образцы), исключить попадание частиц губной помады. Ложноположительные результаты кортизола слюны могут быть обусловлены микрокровотечениями из десен, приемом препаратов лакрицы или использованием кремов или гелей для полости рта с глюкокортикоидами.
Таким образом, для исключения надпочечникового генеза АГ необходимо лабораторное обследование пациента, которое позволит исключить:
1) гиперпродукцию альдостерона (определение АРС);
2) катехоламинпродуцирующую опухоль (определение метанефринов и норметанефринов);
3) гиперпродукцию кортизола — проведение дексаметазонового (1 мг) супрессивного теста, определение суточной экскреции кортизола с мочой, ночное определение кортизола в слюне.
Клинический случай
Больная К., 44 лет, обратилась к эндокринологу с жалобой на чувство «комка» в области щитовидной железы. Из анамнеза: в течение 8 лет страдает артериальной гипертензией, наблюдается кардиологом. Принимает гипотензивные препараты (ингибитор АПФ + диуретик) с минимальным эффектом: АД выше 150/80 мм рт.ст., периодические кризы с повышением АД до 220/115 мм рт.ст. Кризы возникают после психоэмоциональной и физической нагрузки.
При осмотре: рост — 167 см, масса тела — 68 кг. ИМТ — 24 кг/м2. Общее состояние пациентки удовлетворительное. Умеренного питания. Распределение подкожно-жировой клетчатки равномерное. Кожа умеренной влажности. Патологической пигментации и трофических изменений кожи не выявлено. Щитовидная железа пальпаторно не увеличена, диффузная. Сердечные тоны ритмичные, приглушены, патологические шумы не прослушиваются. ЧСС — 80 уд/мин. АД — 160/100 мм рт.ст. В легких везикулярное дыхание. Живот мягкий, безболезненный. Печень не увеличена. Симптом Пастернацкого отрицательный с обеих сторон. Физиологические отправления в норме.
Результаты обследования. УЗИ щитовидной железы: V правой доли — 6,4 см3, V левой доли — 7,2 см3. Эхогенность не изменена. Структура однородная. Очаговые образования не визуализируются.
Принимая во внимание наличие у пациентки артериальной гипертензии, рекомендовано лабораторное обследование с целью исключения эндокринных причин артериальной гипертензии. Результаты лабораторных исследований: метанефрины плазмы — 1286 нг/л (норма до 90); норметанефрины плазмы — 448 нг/л (норма до 200); альдостерон — 28 нг/дл (норма 7–30); ренин — 6,2 нг/л (норма 4,4–46,1); АРС — 4,5 (норма 3,8–7,7); кортизол слюны (в 23:00) — 0,95 (норма в 23:00 < 1,45 нг/мл).
Учитывая высокие уровни метанефринов и норметанефринов, рекомендовано инструментальное дообследование — компьютерная томография (КТ) забрюшинного пространства с целью выявления катехоламинпродуцирующей опухоли. При КТ выявлена опухоль левого надпочечника округлой формы с четкими контурами диаметром 4,6 см, нативная плотность образования — 46 НU, плотность после введения контрастного вещества — 76 HU. Учитывая результаты КТ (высокие показатели КТ нативной и контрастной плотности) и лабораторного обследования, был поставлен предварительный диагноз: феохромоцитома левого надпочечника.
Больной произведена операция: левосторонняя адреналэктомия. Патогистологическое заключение: левый надпочечник с опухолью (феохромоцитома левого надпочечника с кровоизлияниями и дистрофическими изменениями). Диагноз при выписке: феохромоцитома левой надпочечной железы.
Таким образом, наличие у пациента АГ требует от врача тщательного обследования на предмет исключения вторичного характера АГ, а именно надпочечникового генеза.
1. Рекомендации по лечению артериальной гипертонии ESH/ESC 2013 // Российский кардиологический журнал. — 2014. — № 1(105). — С. 7–94.
2. Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр) // Системные гипертензии. — 2010. — № 3. — С. 5–26.
3. Левитская З.И. Первичный идиопатический гиперальдостеронизм в клинической перспективе / З.И. Левитская, А.А. Вабищевич, Е.В. Перистая // Лечащий врач. — 2007. — № 3. — С. 76–79.
4. Чихладзе Н.М. Симптоматическая артериальная гипертония при первичном и вторичном гиперальдостеронизме / Н.М. Чихладзе, И.Е. Чазова // Consilium Medicum. Артериальная гипертензия. — 2007. — Т. 9, № 1. — С. 10–14.
5. Диагностика и лечение первичного гиперальдостеронизма / П.С. Ветшев и др. // Проблемы эндокринологии. — 2004. — Т. 50, № 6. — С. 18–26.
6. Объемные образования надпочечников (диагностика и дифференциальная диагностика): Методические рекомендации для врачей, оказывающих специализированную медицинскую помощь / Е.А. Трошина и др.; под ред. И.И. Дедова, Г.А. Мельниченко // Consilium Medicum. — 2009. — Т. 11, № 12. — С. 76–94.
7. Бельцевич Д.Г. Дифференциальная диагностика первичного гиперальдостеронизма и показания к операции / Д.Г. Бельцевич, Н.С. Кузнецов, А.Р. Ирмякова // Проблемы эндокринологии. — 2007. — Т. 53, № 6. — С. 48–50.
8. Подзолков В.И. Первичный гиперальдостеронизм: диагностика и лечение / В.И. Подзолков, А.В. Родионов // Артериальная гипертензия. — 2004. — Т. 10, № 2. — С. 109–114.
9. Гипокалиемия у взрослых / Л.В. Козловская и др. // Consilium medicum. — 2005. — Т. 4, № 3. — С. 3–7.
10. Павленко А.К. Диагностика первичного гиперальдостеронизма / А.К. Павленко, В.В. Фадеев, Г.А. Мельниченко // Проблемы эндокринологии. — 2001. — Т. 47, № 2. — C. 15–25.
11. Баронин А.А. Первичные и метастатические опухоли надпочечников / А.А. Баронин, В.Ю. Сельчук, А.В. Филимонюк // Онкология. — 2005. — Т. 13, № 13. — С. 862–868.
12. Ветшев П.С. Диагностика и лечение первичного гиперальдостеронизма / П.С. Ветшев, Г.В. Полунин, В.А. Сотникова // Хирургия. Журнал им. Н.И. Пирогова. — 2004. — Т. 50, № 6. — С. 18–26.
13. Case detection, diagnosis and treatment of patients with primary aldosteronism: an endocrine society clinical practice guideline / J. W. Funder et al. // J. Clinical Endocrin. Metab. — 2008. — № 93(9). — P. 3266–3281.
14. Устюгова А.В. Скрининговое обследование пациентов с инциденталомой надпочечника / А.В. Устюгова, М.Ф. Калашникова, Д.Г. Бельцевич // Проблемы эндокринологии. — 2008. — Т. 5, № 4. — С. 45–48.
15. Синдром Конна: клиника, дифференциальный диагноз и лечение / Н.М. Чихладзе и др. // Хирург. — 2005. — № 6. — С. 21–26.
16. Оцінка гормональної активності інсиденталом надниркових залоз / Л.К. Куліков та ін. // Клінічна ендокринологія та ендокринна хірургія. — 2007. — № 2(19). — С. 77–78.
17. Дифференциальная диагностика первичного гиперальдостеронизма: роль и место сравнительного селективного забора крови из надпочечниковых вен / И.И. Ситкин и др. // Проблемы эндокринологии. — 2011. — № 2. — С. 52–56.
18. American association of clinical endocrinologists and American association of endocrine surgeons medical guidelines for the management of adrenal incidentaloma / M.A. Zeiger et al. // Endocrine practice. — 2009. — Vol. 15, July — August. — Р. 1–20.
19. Adrenal incidentaloma: a diagnostic challenge / P. Anagnostis et al. // Hormones. — 2009. — № 8(3). — Р. 163–184.
20. Бельцевич Д.Г. Феохромоцитома / Д.Г. Бельцевич, Е.А. Трошина, М.Ю. Юкина // Проблемы эндокринологии. — 2010. — № 1. — С. 63–71.
21. Зубкова С.Т. Особенности сердечно-сосудистых нарушений при феохромоцитоме / С.Т. Зубкова // Здоровье Украины. — 2007. — № 10/1. — С. 56–57.
22. Коваленко А.Е. Феохромоцитома: современные подходы к диагностике и лечению / А.Е. Коваленко // Здоров’я України. — 2007. — № 22/1. — С. 75–77.
23. Чачибая В.А. Клиническая картина и методы гормональной диагностики хромаффином / В.А. Чачибая, М.А. Коринтели, К.Г. Бочоришвили // Медицинские новости Грузии. — 2004. — Т. 116, № 1. — С. 43–45.
24. Трошина Е.А. Лабораторная диагностика феохромоцитомы / Е.А. Трошина, Д.Г. Бельцевич, М.Ю. Юкина // Проблемы эндокринологии. — 2010. — № 4. — С. 39–43.
25. Феохромоцитома / Дедов И.И., Бельцевич Д.Г., Кузнецов Н.С., Мельниченко Г.А. — М.: Практическая медицина, 2005. — 216 с.
26. Perry C.G., Sawka A.M., Singh R. et al. The diagnostic efficacy of urinary fractionated metanephrines measured by tandem mass spectrometry in detection of pheochromocytoma // Clin. Endocrinol. (Oxf.) — 2007. — 66. — P. 703–708.
27. Pheochromocytoma: recommendations for clinical practice from the First International Symposium / K. Pacak et al. // Nat. Clin. Pract. Endocrinol. Metab. — 2007. — № 3(2). — Р. 92–102.

/118/118.jpg)