Международный эндокринологический журнал 3 (67) 2015
Вернуться к номеру
Оптимізація діагностики і лікування хворих на ускладнений інфаркт міокарда із цукровим діабетом 2-го типу
Авторы: Савченко І.П. — ДВНЗ «Тернопільський державний медичний університет ім. І.Я. Горбачевського МОЗ України»
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Вивчено вплив комплексного лікування з додатковим включенням системної ензимотерапії на клінічні прояви постінфарктного синдрому, параметри кардіогемодинаміки та показники вільнорадикального окислення ліпідів у 42 хворих на інфаркт міокарда з цукровим діабетом 2-го типу та без нього. Встановлено, що додаткове проведення системної ензимотерапії дозволяє досягти позитивного клінічного, гемодинамічного та стійкого антиоксидантного ефекту у хворих із постінфарктним синдромом і цукровим діабетом 2-го типу.
Изучено влияние комплексного лечения с дополнительным включением системной энзимотерапии на клинические проявления постинфарктного синдрома, параметры кардиогемодинамики и показатели свободнорадикального окисления липидов у 42 больных инфарктом миокарда при сахарном диабете 2-го типа и без него. Установлено, что дополнительное включение системной энзимотерапии позволяет достичь положительного клинического, гемодинамического и устойчивого антиоксидантного эффекта у больных с постинфарктным синдромом и сахарным диабетом 2-го типа.
The influence of combined treatment with the additional including of systemic enzyme therapy on the clinical manifestations of postinfarction syndrome, cardiohemodynamic parameters and free radical lipid peroxidation indexes has been studied in 42 patients with myocardial infarction and type 2 diabetes mellitus or without it. It was found that additional systemic enzyme therapy enables to achieve positive clinical, hemodynamic and persistent antioxidant effect in patients with postinfarction syndrome and type 2 diabetes mellitus.
цукровий діабет 2-го типу, постінфарктний синдром, перекисне окислення ліпідів, антиоксидантна система захисту.
сахарный диабет 2-го типа, постинфарктный синдром, перекисное окисление липидов, антиоксидантная система защиты.
type 2 diabetes mellitus, postinfarction syndrome, lipid oxidation, antioxidant protection system.
Статья опубликована на с. 161-165
Вступ
Ішемічна хвороба серця (ІХС) залишається провідною причиною смерті в розвинутих країнах, особливо серед хворих на цукровий діабет (ЦД) 2-го типу [9, 11]. Найтяжчим несприятливим наслідком ІХС, незважаючи на успіхи у вивченні патогенезу, клініки і лікування, залишається гострий інфаркт міокарда (ГІМ) та його ускладнення [1, 2].
Проблема ефективного лікування ГІМ та його ускладнень у хворих на ЦД 2-го типу нероздільно пов’язана з виявленням особливостей патогенетичних механізмів прогресування недуги у цієї категорії пацієнтів, взаємозалежністю порушень вуглеводного і ліпідного обміну, функціонування ендотелію, імунологічних зрушень [1].
Процес вільнорадикального окислення ліпідів (ВРОЛ) у міокарді є необхідною умовою нормального динамічного функціонування ліпідної фази біологічних мембран, що, у свою чергу, визначають характер, інтенсивність та кінетику метаболізму кардіоміоцитів [3, 5]. Однак дані клінічних та експериментальних досліджень свідчать про те, що надмірна інтенсифікація перекисного окислення ліпідів (ПОЛ) при ГІМ стає одним із провідних патогенетичних механізмів розширення зони некрозу і розвитку ускладнень, які визначають наслідки захворювання [5]. Згідно з даними літератури, підвищення активності ПОЛ і/або зниження рівня функціонування антиоксидантних систем захисту (АОСЗ) може бути пов’язано зі стимуляцією автоімунного запалення, що відіграє суттєву роль у розвитку такого ускладнення ГІМ, як післяінфарктний синдром (ПС) [11].
Багатогранність патогенезу інфаркту міокарда, особливо у пацієнтів із ЦД, що, у свою чергу, поглиблює патологічний перебіг процесів в організмі, обумовлює актуальність пошуку нових способів корекції імунних та перекисних порушень, які суттєво погіршують перебіг основного захворювання і можуть сприяти розвитку таких загрозливих ускладнень, як аритмії та серцева недостатність. Останніми роками до цих засобів зараховують препарати системної ензимотерапії, що мають значну протизапальну, імуномодулюючу, фібринолітичну дію і сприяють виникненню вторинного анальгезуючого ефекту [10]. Однак ефективність їх використання при ЦД 2-го типу у хворих на ГІМ, ускладнений ПС, не вивчалась.
Крім того, слід відзначити значну роль порушень кардіогемодинаміки у прогресуванні захворювання і визначенні подальшого прогнозу його наслідків у цієї категорії пацієнтів. Відомо, що післяінфарктне ремоделювання серця визначає ступінь тяжкості серцевої недостатності і тактику лікування пацієнтів із ГІМ. У той же час вивчення характеру змін гемодинаміки при ускладненому автоімунними процесами перебігу інфаркту міокарда за наявності у хворих ЦД 2-го типу не проводилося.
Мета дослідження — вивчити клініко-патогенетичні особливості перебігу захворювання, показники ПОЛ/АОСЗ та параметри кардіогемодинаміки у хворих на інфаркт міокарда, ускладнений ПС, на тлі ЦД 2-го типу та без нього і їх динаміку під впливом комплексного лікування з включенням системної ензимотерапії.
Матеріали та методи дослідження
Під спостереженням перебували 42 хворі з Q-інфарктом міокарда, госпіталізовані у клініку на першу добу захворювання. Діагноз ГІМ встановлювали відповідно до Третього універсального визначення інфаркту міокарда (2012) на основі аналізу клінічних, електрокардіографічних, візуалізаційних та ензимологічних методів дослідження. Критеріями виключення були хворі з тяжкою супутньою артеріальною гіпертензією, хронічними захворюваннями нирок та легень, імунопатологією, ЦД у стані декомпенсації. Пацієнтам проводили стандартну загальноприйняту терапію [8]. Верифікацію ПС здійснювали на підставі появи на 10–14-ту добу захворювання лейкоцитозу до 11,2 ± 0,7 Г/л, еозинофілії до 6,4 ± 0,06 %, підвищення швидкості осідання еритроцитів до 30,3 ± 1,1 мм/год, при відсутності повторного підвищення значень показників аспартатамінотранферази, аланінамінотрансферази, МВ-фракції креатинфосфокінази, за наявності перикардиту, плевриту, підтверджених за допомогою електрокардіографії, ехокардіографії (ЕхоКГ), рентгенологічно.
Залежно від наявності супутньої патології, а саме ЦД 2-го типу, сформовано дві групи спостереження. В І групу ввійшли 22 хворі із ПС без коморбідності. В ІІ групу ввійшли 20 хворих із ПС, які страждають від ЦД 2-го типу тривалістю до п’яти років (у середньому 3,9 ± 1,2 року). Термін перебування на стаціонарному етапі становив 21,5 ± 2,5 доби. Групу порівняння становили 20 здорових осіб, порівнянних за віком і статтю. Пацієнти обох груп були порівняні також і за локалізацією та величиною некрозу, наявністю повторного інфаркту міокарда, тривалістю госпіталізації. У комплексну терапію хворих І та ІІ груп додатково включали препарат системної ензимотерапії вобензим (Mucos Pharma, Німеччина) в дозі 9 драже на добу безперервним курсом до трьох тижнів (19 ± 2 дні).
Визначення вмісту малонового діальдегіду (МДА) як одного з прикінцевих продуктів ліпопероксидації проводили за методом L. Placer et al. Стан активності АОСЗ вивчали на підставі визначення супероксиддисмутази (СОД) [3], рівня церулоплазміну в сироватці крові [6]. Вміст SH-груп визначали за методом Торчинського (1977).
Постінфарктне ремоделювання серця вивчали за допомогою B, D-ЕхоКГ за стандартними методиками (Feigenbaum H., 1990). Для оцінки систолічної функцїї лівого шлуночка (ЛШ) проводили розрахунок об’ємних показників у двомірному режимі. Для вивчення скоротливої здатності міокарда ЛШ розраховували кінцево-систолічний індекс скоротливості (КСІС) (кінцево-систолічний тиск (КСТ)/кінцево-систолічний об’єм, мм рт.ст./мл), що відносно мало залежить від перед- та післянавантаження; визначали лінійні розміри лівого передсердя в діастолу (ЛП, см), а також середній тиск в легеневій артерії (ТЛАср, мм рт.ст.). При аналізі трансмітрального кровотоку визначали показники діастолічної функції ЛШ: відношення максимальних значень раннього та пізнього діастолічного кровотоку (Е/А), а також показник IVRT. За формулою T.K. Stork (1989) визначався кінцево-діастолічний тиск (КДТ) ЛШ (мм рт.ст.).
Результати досліджень підлягали статистичному аналізу за допомогою пакета програм Statistiсa for Windows версії 6.0 на персональному комп’ютері, для порівняння між двома групами використовувався непарний коефіцієнт Стьюдента. Значення (Р < 0,05) вважалося статистично значущим.
Результати та їх обговорення
При аналізі клінічних особливостей захворювання виявлено, що розвиток ПС у хворих на ГІМ І групи супроводжувався повторною кардіалгією, появою або поглибленням ознак серцевої недостатності (тахікардія, тахіпное, ослаблення тонів при аускультації, акцент ІІ тону над легеневою артерією), порушенням ритму або провідності (відповідно у 36,4 та 40,9 % хворих), посиленням проявів запально-інтоксикаційного синдрому (серцебиття, загальна слабкість та швидка втомлюваність). В основному у пацієнтів І групи траплялися типові форми ПС, переважно моносимптомні — у 63,6 % випадків.
У той же час у хворих на ЦД 2-го типу та ГІМ, що ускладнився розвитком ПС (ІІ група), клінічний перебіг захворювання вирізнявся відсутністю вираженого повторного больового синдрому, посиленням тахікардії, тахіпное, ослабленням тонів при аускультації; порушення ритму та/або провідності спостерігалися частіше (відповідно у 60 та 70 % хворих), поширення ішемічного ураження міокарда відбувалося паралельно з посиленням проявів запально-інтоксикаційного синдрому (задишка, серцебиття, підвищена пітливість, субфебрилітет). Моносимптомні форми післяінфарктного синдрому в ІІ групі пацієнтів траплялися у 40 % випадків, перикардіально-плеврально-пневмонічний варіант — в одного хворого (5 %), перикардіально-плевральний — у трьох (15 %), перикардіально-пневмонічний — у п’яти (25 %), плевропневмонічний варіант — у трьох (15 %) пацієнтів.
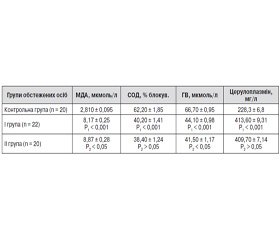
Дослідження показників перекисного окислення ліпідів і активності антиоксидантних систем захисту організму показали, що у хворих на інфаркт міокарда із ПС на тлі ЦД 2-го типу в підгострому періоді захворювання виявлено більш суттєву активацію процесів ПОЛ та значне пригнічення АОСЗ порівняно з відповідними показниками пацієнтів І групи (табл. 1).
Зокрема, концентрація МДА в крові хворих з автоімунними ускладненнями та супутнім ЦД 2-го типу виявилась на 8,6 % вищою (р < 0,05), а SH-групи — на 5,9 % (р < 0,05) нижчими, ніж у пацієнтів із ПС без коморбідності, що вказувало на більшу розбалансованість у діяльності системи «ПОЛ — АОСЗ», очевидно, за рахунок наявності додаткового фактора агресії — розвитку автоімунного запалення в організмі в цілому та в міокарді зокрема на тлі порушень вуглеводного обміну. Як свідчать дані, наведені в табл. 1, у хворих обох груп відзначалося статистично вірогідне пригнічення активності СОД (відповідно на 35,4 і 38,3 %), зменшення вмісту SH-груп (відповідно на 33,9 і 37,7 % ), зростання рівня церулоплазміну в 1,8 раза). Подібні зміни останнього показника характерні також і для багатьох системних захворювань сполучної тканини, як це було продемонстровано в роботах інших дослідників [2, 7, 13]. Можливо, це пояснюється тим, що в церулоплазміні знаходиться значна частина міді плазми крові, її виявлено також у супероксиддисмутазі еритроцитів та лейкоцитів, а міді, вважають, властива виражена протизапальна дія.
Пацієнтам обох груп поряд із загальноприйнятою схемою лікування недуги після появи ознак автоімунних ускладнень додатково призначали вобензим, що супроводжувалося позитивною динамікою суб’єктивних та об’єктивних проявів захворювання, а також більшості клініко-функціональних тестів: зменшувалися задишка, прискорене серцебиття, тахіпное, синусова тахікардія (у 31,8 % хворих на інфаркт міокарда, ускладнений ПС, І групи та у 55 % пацієнтів ІІ групи).
У табл. 2 відображена динаміка показників ПОЛ і АОСЗ під впливом тритижневого курсу загальноприйнятого лікування з додатковим включенням системної ензимотерапії. Наприкінці госпітального періоду захворювання концентрація МДА у хворих на ПС І групи зменшилась на 40,63 % порівняно з показниками первинного дослідження, а рівень SH-груп збільшився на 24,49 %, концентрація СОД зросла на 35,07 %, рівень церулоплазміну зменшився на 25,92 %. Вивчення результатів дослідження через 3 тижні лікування свідчить про істотне зменшення активності ВРОЛ під впливом модифікованої вобензимом комплексної терапії, на що вказує вірогідне зменшення концентрації МДА в сироватці крові та істотне підвищення ферменту СОД і глутатіонової системи антиоксидантного захисту у хворих на ПС, проте жоден досліджуваний показник ВРОЛ не досяг фізіологічної норми.
Виявлено, що у пацієнтів ІІ групи спостереження, попри суттєву активацію ПОЛ і значне пригнічення АОСЗ у початковому стані (навіть порівняно з хворими на ПС без коморбідності), в результаті проведеного лікування було досягнуто вірогідне зниження концентрації прикінцевого продукту ліпопероксидації — МДА, церулоплазміну та підвищення показників АОСЗ — СОД, глутатіону відновленого (р < 0,01). Загалом нормалізація параметрів ліпопероксидації та антиоксидантного захисту за результатами лікування із застосуванням системної ензимотерапії відбулася у вірогідно більшої частки пацієнтів ІІ групи порівняно з результатами лікування хворих І групи (р < 0,05). Зокрема, у 25 % обстежених хворих ІІ групи спостерігалося повернення до норми концентрації МДА (проти 13,6 % у І групі пацієнтів), у 65 % хворих — величини СОД (проти 27,3 % у І групі), у 30 % хворих — рівня SH-груп (проти 22,7 % у І групі).
Неможливість досягнення рівноваги в системі ПОЛ/АОСЗ в обстежених хворих на інфаркт міокарда з ускладненим перебігом, особливо на тлі ЦД 2-го типу, незважаючи на застосування додаткових антиоксидантних схем лікування вобензимом, дозволяє припустити, що причиною дисфункції в системі з досить глибокими і стійкими метаболічними зрушеннями є односпрямований вплив кількох патогенетичних факторів (гіпоксія, некроз кардіоміоцитів, апоптоз, автоімунне запалення) [1], а тому увагу лікарів слід зосередити на вивченні інших можливих механізмів дисбалансу в організмі в умовах коморбідності, зокрема на гемодинамічних порушеннях.
Так, у хворих на ускладнений інфаркт міокарда та ЦД 2-го типу виявлено дилатацію порожнин лівих відділів серця (вірогідне збільшення кінцево-діастолічного об’єму (КДО) на 18,6 %), порушення скоротливої і насосної здатності міокарда (зниження величини УІ на 28 %, КСІС на 20,1 %), виражену діастолічну дисфункцію лівого шлуночка (збільшення параметра Е/А на 28,3 %, iVRT на 50 %) на тлі зростання його КДТ (на 18,8 %) та ТЛАср (на 32,4 %) порівняно з пацієнтами І групи. Слід відзначити, що на тлі запропонованої комплексної терапії у хворих на ПС через 14–18 днів спостерігається тенденція до зниження КДО, кінцевого систолічного об’єму, ударного об’єму, проте різниця між досліджуваними показниками до та після лікування є невірогідною, також це не сприяло відновленню скоротливої здатності міокарда ЛШ. Динаміка показників діастолічної функції ЛШ серця у хворих на інфаркт міокарда з ПС та ЦД 2-го типу показала, що середні показники діастолічної функції ЛШ серця вірогідно не відрізняються від початкових величин. При цьому встановлено, що індивідуально вони коливаються як у бік зростання, так і в бік зниження. Через три тижні лікування вказана терапія уповільнювала темпи прогресування серцевої недостатності при ПС, сприяла деякому покращенню окремих показників систоло-діастолічної дисфункції міокарда ЛШ (порівняно з І групою: зниження КДО (на 4,9 %), КДТ (на 12,1 %) на фоні вищих значень УІ (на 17 %), фракції викиду (на 2 %), КСІС (на 36,7 %), вірогідне підвищення значення (Е/А) та вкорочення IVRT при вірогідно меншому діастолічному розмірі ЛП). Проте загалом параметри інтракардіальної гемодинаміки під впливом запропонованих схем лікування суттєво не змінилися. Це спонукає до пошуків новітніх модифікованих програм медикаментозного лікування з огляду на часту поліморбідність у цієї когорти пацієнтів.
Узагальнюючи проведені дослідження, слід відзначити, що у пацієнтів з ускладненим перебігом інфаркту міокарда, особливо за наявності ЦД 2-го типу, зберігається гіперліпопероксидація та недостатність АОСЗ, тобто зберігаються субстрат та умови для прогресування (поглиблення) структурно-функціональної дезорганізації клітинних мембран імунокомпетентних клітин [14]. Блокування одного з ключових ферментів антиоксидантного захисту — СОД — створює умови для надмірного утворення активних форм кисню в процесі розвитку запальних явищ. Активація процесів вільнорадикального окислення фосфоліпідів і білків клітинних мембран призводить до втрати ними структури і функції, загибелі клітин та формування порочного кола прогресування захворювання [4]. Включення в комплексну терапію препарату системної ензимотерапії сприяло більш швидкому регресу клінічних ознак хвороби та нормалізації параметрів ВРОЛ, відновленню активності АОСЗ. Одним із механізмів антиоксидантної дії вобензиму може бути його участь у відновленні S-S-зв’язків у молекулах ферментних, неферментних білків та небілкових S-S-вмісних сполуках до SH-груп. Останні можуть проявляти антирадикальний ефект. Не виключається можливість безпосередньої взаємодії препаратів системної ензимотерапії з активними формами кисню.
Висновки
1. У процесах прогресування автоімунних ускладнень ГІМ у пацієнтів із ЦД 2-го типу важливу патогенетичну роль відіграють зміни активності ПОЛ та пригнічення АОСЗ організму.
2. Параметри ПОЛ і АОСЗ можуть бути використані для динамічного спостереження за перебігом ПС і оцінки ефективності та адекватності використаних програм лікування.
3. Завдяки застосуванню поліензимного препарату вобензим можна досягнути більш якісного клінічного ефекту та запобігти прогресуванню автоімунних ускладнень через пригнічення ПОЛ і відновлення функціональної здатності АОСЗ у таких хворих.
1. Амосова К.М., Безродний А.Б., Прудкий І.В. та ін. Особливості клінічного перебігу, прогнозу та морфо-функціонального стану міокарда у хворих на Q-інфаркт міокарда з ранньою систолічною дисфункцією лівого шлуночка в сучасних умовах лікування віку // Український медичний часопис. — 2005. — № 4(48), VІІ/VІІІ. — С. 56–60.
2. Дзяк Г.В., Коваль О.А., Каплан П.А., Півняк А.Г. Запалення та імунопатологічні зміни при гострих коронарних синдромах: чи необхідна зміна стандартів терапії? // Нова медицина. — 2003. — № 4(9). — С. 26–31.
3. Дубинина Е.Е., Сальникова А.А. Активность и изоферментный спектр супероксиддисмутазы эритроцитов и плазмы крови человека // Лаб. дело. — 1998. — № 3. — С. 30–33.
4. Караванська І.Л. Клініко-імунологічна оцінка ефективності застосування корвітину у хворих на гострий інфаркт міокарда: Автореф. дис… канд. мед. наук: 14.01.11 / І.Л. Караванська; Дніпропетр. держ. мед. акад. — Дн., 2004. — 21 с.
5. Кінах М.В., Чиж В.Д., Полторак Л.А. Діагностичне і прогностичне значення дослідження перекисного окислення ліпідів (ПОЛ) у хворих на інфаркт міокарда в гострий період // Актуальные вопросы кардиологии и организации кардиологической помощи населению: Мат-лы науч.-практ. конф. — Одесса, 1994. — С. 81–82.
6. Колб В.Г., Камышников В.С. Клиническая биохимия. — Минск: Беларусь, 1986. — 312 с.
7. Микуляк В.Р. Комплексна оцінка функціонального стану ендотелію у хворих на гострий інфаркт міокарда // Вісник української медичної стоматології. — 2013. — Т. 13, № 3(43). — С. 186–190.
8. Наказ Міністерства охорони здоров’я України № 455 від 02.07.2014 р. «Уніфікований клінічний протокол екстреної, первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації «Гострий коронарний синдром з елевацією сегмента ST». — 92 с.
9. Паньків В.І. Цукровий діабет, переддіабет і серцево-судинні захворювання. Аналіз рекомендацій Європейського товариства з кардіології (ESC) і Європейської асоціації з вивчення діабету (EASD) // Практична ангіологія. — 2007. — № 2(7).
10. Системная энзимотерапия. Теоретические основы, опыт клинического применения / Под ред. К.Н. Веремеенко, В.Н. Коваленко. — К.: Морион, 2000. — 320 с.
11. Следзевская И.К., Бабий Л.Н., Щербак Я.Ю. Системная энзимотерапия как метод вторичной профилактики у больных, перенесших инфаркт миокарда // Мат-лы симп. по системной энзимотерапии. — К., 1998. — С 54–63.
12. Соломенчук Т.М., Скибчик В.А. Особливості перебігу інфаркту міокарда у хворих на цукровий діабет 2 типу залежно від статі та віку // Український медичний часопис. — 2004. — № 2(40), ІІІ/IV. — С. 115–118.
13. Трохимович А.А. Стан антиоксидантної системи та його корекція при коронарних ураженнях серця // Український ревматологічний журнал. — 2001. — № 3–4 (5–6). — С. 86–88.
14. Kanda T., Inoue M., Kotajima N. et al. Circulating interleukin-6 and interleukin-6 receptors in pts with acute and recent myocardial infarction // Cardiol. Ads. — 2008. — 93(3). — P. 191–196.

/163/163.jpg)